1. Введение
В последнее время дефекты и нарушения костной ткани, а также связанные с ними заболевания вызывают серьезную озабоченность общественного здравоохранения из-за увеличения числа пожилых людей, получающих травмы, опухолей костей,
травм в результате занятий спортом и дорожно-транспортных происшествий. В связи со старением населения и увеличением продолжительности жизни остеопороз все чаще становится глобальной проблемой здравоохранения
. Число пожилых людей быстро растет в Азиатско-Тихоокеанском регионе, Европе и Северной Америке. Остеопороз возникает в результате снижения прочности и плотности костей, что приводит к повышенному риску переломов хрупкости у пожилых людей
Кроме того, онкологические больные также страдают остеопорозом из-за ускоренной потери костной массы при химиотерапии и применении лекарственных препаратовТаким образом, остеопороз является заболеванием костей, оказывающим большое
влияние на заболеваемость и смертность Таким образом, спрос на использование костных трансплантатов во всем мире возрастает, и хирурги используют аутотрансплантаты, аллотрансплантаты или ксенотрансплантаты для лечения пациентов с серьезными
повреждениями костей . Аутотрансплантаты, удаленные из костей пациентов, обладают остеоиндуктивными, остеокондуктивными и остеогенными свойствами. Однако аутотрансплантаты страдают от боли в донорском участке, воспаления и
заболеваемости, а также осложнений после сбора костных трансплантатов. Аллотрансплантаты и ксенотрансплантаты несут в себе риск иммунологического отторжения и возможной передачи заболевания. В этом отношении было показано, что инженерия костной ткани,
особенно разработка синтетических заменителей костных трансплантатов и 3D-пористых каркасов, эффективна в стимулировании восстановления и реконструкции костных дефектов и для устранения риска передачи заболеваний
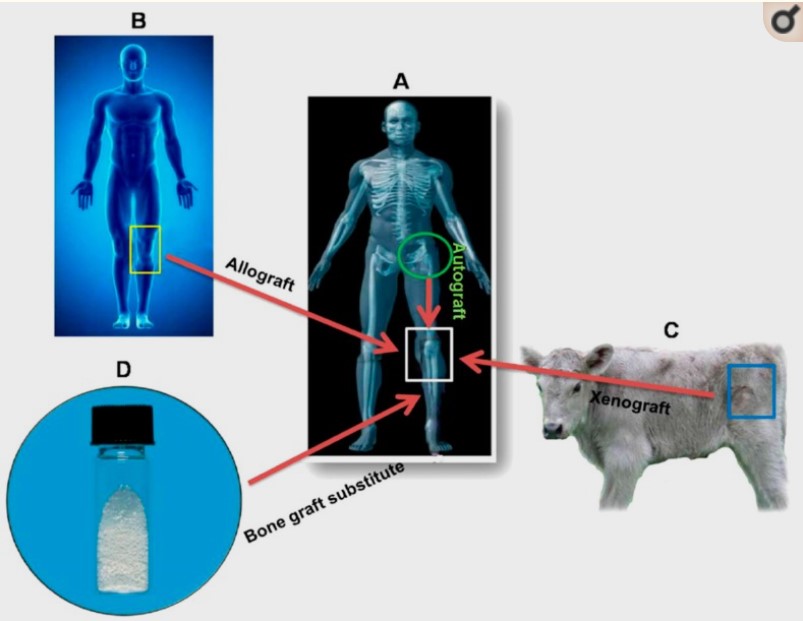
Схема, показывающая типы костных трансплантатов, которые должны быть имплантированы в организм человека: (А) аутотрансплантат, (Б) аллотрансплантат, (В) ксенотрансплантат и (Г) синтетический заменитель костного трансплантата.
[], опубликовано компанией BioMed Central Ltd. по лицензии Creative Commons Attribution.
В инженерии костной ткани пористые каркасы служат искусственным внеклеточным матриксом (ECM), обеспечивающим структурную и механическую поддержку для прикрепления, распространения,
размножения и дифференцировки костных клеток, тем самым выступая в качестве шаблона для выращивания клеток для регенерации костной ткани. Каркасы для инженерии костной ткани должны быть остеоиндуктивными, остеокондуктивными и остеоинтегративными.
Эти свойства обеспечивают прочную интеграцию каркасов с тканью хозяина при трансплантации Каркасы разработаны таким образом, чтобы соответствовать механическим свойствам трабекулярных костей человека.
В целом, модуль сжатия и прочность на сжатие трабекулярных костей в значительной степени зависят от влажных/сухих условий, плотности, пористости и анатомического расположения костей []. Кроме того, каркасы должны быть трехмерными (3D), высокопористыми с размерами пор ≥100 мкм и сильно взаимосвязанной структурой пор, чтобы способствовать росту костей, транспортировке питательных веществ и удалению метаболических отходов
Пористые 3D-каркасы с клетками или без клеток и факторами роста, такими как костный морфогенетический белок-2 (BMP-2), трансформирующий фактор роста-β (TGF-β), затем трансплантируются в дефектные участки кости [].
Для обнаженного каркаса клетки будут набираться in vivo из ткани хозяина. Металлы и их сплавы часто используются для восстановления переломов костей из-за их выдающихся механических свойств. Однако модуль упругости нержавеющих сталей и сплавов на основе Ti
, обычно используемых в биомедицинских целях, намного выше, чем у человеческих костей, что приводит к так называемому эффекту "защиты от напряжений" . Кроме того, металлы всегда страдают от проблем с коррозией.
Коррозия и высвобожденные ионы могут вызывать реакцию воспаления, апоптоз клеток и реакцию инородного тела. Магний и его сплавы с механическими свойствами, близкими к свойствам кортикальных костей человека,
находят полезное применение в качестве устройств для фиксации костей и каркасов Они разлагаются в физиологической среде. Однако трудно точно контролировать морфологию пор Mg-каркасов с хорошей механической прочностью.
Кроме того, высокая скорость коррозии материалов на основе Mg и повышение рН в окружающих тканях из-за высвобождения ионов Mg, как правило, ограничивают их применение в качестве биоразлагаемых каркасов в ортопедии
Полимеры с хорошей обрабатываемостью и малым весом являются идеальными материалами для биомедицинских применений .
Полимеры могут быть синтезированы и адаптированы для удовлетворения конкретных потребностей и применений путем контроля их химического состава и структуры.
Как таковые, они находят привлекательные биомедицинские применения в тканевой инженерии, терапии и доставке лекарств .
Из литературы следует, что неразлагаемый полиэфирэфиркетон (PEEK) с высокой термостойкостью, отличной радиационной стабильностью и высокой жесткостью был разработан для изготовления каркасов для межтелового спондилодеза . Однако плохое поведение
PEEK при деградации ограничивает его дальнейшее применение в инженерии костной ткани. В отличие от этого, разлагаемые полимеры, включая натуральные и синтетические, обычно используются для применения в инженерии костной ткани. Для этих целей было использовано несколько природных полимеров, таких как коллаген, хитозан, желатин, альгинат, а также синтетические полимеры, такие как алифатические полиэфиры и гидрофильный поливиниловый спирт
. Биоразлагаемые алифатические полиэфиры включают поли(молочную кислоту) (PLA), поли(гликолевую кислоту) (PGA), поликапролактон (PCL) и сополимеры PLA-PGA (PLGA).
Коллаген наиболее широко адаптирован в каркасы, поскольку он представляет собой органическую фазу костной ткани. Коллаген может быть извлечен из животных (бычьей и свиной кожи/костей) и морских источников .
Однако коллаген животного происхождения может представлять опасность для здоровья и безопасности населения из-за недавней вспышки инфекционных заболеваний домашнего скота, например, губчатой энцефалопатии крупного рогатого скота и африканской чумы свиней.
Кроме того, коллаген и другие природные полимеры также страдают от низкой механической прочности, низкой термической стабильности и обрабатываемости, а также плохого контроля скорости деградации.
Таким образом, синтетические полимеры обладают многими преимуществами по сравнению с природными полимерами для изготовления костных каркасов, включая индивидуальную скорость деградации и более высокую механическую прочность .
Костная ткань представляет собой биокомпозит, состоящий из коллагеновых фибрилл и наностержней гидроксиапатита. Гидроксиапатит (Ca10(PO4)6(OH)2) (HA) является хрупким материалом с низкой вязкостью разрушения.
Это исключает его использование в качестве самостоятельного биоматериала в ортопедии. ГК имеет соотношение кальция и фосфата 1,67 и обладает отличной остеокондуктивностью благодаря своему химическому и структурному сходству с неорганическими компонентами костей и зубов человека. Таким образом, полезно включать ГК в полимеры для формирования биокомпозитов с улучшенной адгезией и пролиферацией остеобластов. Например, Бонфилд и его коллеги впервые ввели микрочастицы 40 об.% HA (mHA) в полиэтилен высокой плотности (HDPE) для использования в челюстно-лицевых приложениях без нагрузки
Синтетические алифатические полиэфиры обладают низким сродством к клеткам и низкой биоактивностью костей, поэтому для преодоления этих ограничений полезно включать ГК в эти полимеры. Комбинация разлагаемых
полиэфиров и неорганических биоактивных mHA была изучена несколькими исследовательскими группами . Россия и др. сообщалось, что композиты на основе PLA с 70-85 мас.% mHA проявляют механические свойства, которые
близко соответствуют свойствам кортикальных костей человека . По-видимому, обычные полимерные биокомпозиты требуют очень высоких нагрузок mHA для стимулирования адгезии и пролиферации костных клеток. Это типичное поведение
традиционных полимерных микрокомпозитов.
Недавний прогресс в области нанотехнологий открыл новый путь в разработке передовых функциональных наноматериалов для промышленного и биомедицинского применения . В последнем случае сообщалось, что нанокерамика на основе оксида
алюминия, титана и гидроксиапатита усиливает рост костей благодаря их большой площади поверхности по сравнению с микрозернистыми материалами . Кроме того, нанокерамические поверхности имитируют микроокружение естественных костей,
тем самым способствуя адсорбции белка и стимулируя образование новых костей. В частности, нанокристаллический HA (nHA) способствует адсорбции большого количества витронектина и BMP-2 на его поверхности, что эффективно ускоряет образование новой кости .
Поэтому биоактивность и биосовместимость полимеров, особенно биоразлагаемых алифатических полиэфиров, могут быть значительно улучшены путем добавления наполнителей nHA .
Графен представляет собой двумерный слой sp2-связанных атомов углерода, расположенных в гексагональной решетке. Это строительный блок для нулевого (0D) шара баки и графеновой квантовой точки (GQD), одномерной (1D) углеродной нанотрубки и трехмерного (3D) графита.
Графен обладает исключительно высоким модулем упругости 1 ТПа, высокой электрической подвижностью 2 × 105 см2 В−1 с−1и превосходной прозрачностью света 97,7% . Графен и его производные могут быть изготовлены несколькими способами обработки, что приводит
к получению продуктов с принципиально различными структурными, химическими и физическими свойствами. Графен, полученный методом химического осаждения из паровой фазы (CVD), в основном используется в оптоэлектронных приложениях . Напротив, оксид графена (GO),
полученный химическим окислением графитовых хлопьев в сильных окислителях, и восстановленный оксид графена (rGO), полученный химическим или термическим восстановлением GO, являются отличными кандидатами для биомедицинских применений .
Как правило, изолирующий ГО демонстрирует гораздо более низкий модуль упругости 207,6 ± 23,4 ГПа по сравнению с первозданным графеном . Тем не менее, жесткость GO намного выше, чем у nHA (110 ГПа) .
Таким образом, очень низкое содержание наполнителя GO необходимо для повышения механической прочности и биосовместимости алифатических полиэфиров . Совсем недавно Тджонг и его коллеги продемонстрировали, что гибридные нанокомпозиты PLA,
армированные наполнителями nHA и GO, демонстрируют лучшую совместимость, чем бинарные композиты PLA/nHA. Это связано с тем, что графен и его производные способствуют образованию новой кости, способствуя остеобластической адгезии и росту,
а также остеогенной дифференцировке мезенхимальных стволовых клеток (МСК) на их поверхностях. Аддитивный эффект между нанонаполнителями nHA и GO приводит к дальнейшему повышению механической прочности и биосовместимости PLA.
В этой статье представлен современный обзор последних разработок, механических характеристик, биодеградации in vitro, минерализации и культивирования клеток, а также моделей животных in vivo биоразлагаемых алифатических полиэфиров,
армированных nHA, и/или нанонаполнителей GO для применения в инженерии костной ткани, особенно за последние четыре года.
2. Приготовление нанонаполнителей
2.1. Наногидроксиапатит
Для изготовления NHA было использовано несколько синтетических стратегий, включая влажное химическое осаждение, гидротермальный метод, микроволновое облучение, золь-гель, эмульсию и т.д.
Морфология, размер кристаллитов, стехиометрия и химический состав nHA, полученных из этих путей, существенно отличаются друг от друга . Среди них влажное химическое осаждение является одним из наиболее распространенных методов, используемых для формирования NHA, благодаря своей простоте и простоте изготовления без использования органических растворителей. Для процесса осаждения требуются только недорогие химические реагенты Ca и P. Типичные предшественники Ca включают Ca(OH)2, CaCl2и Ca(NO3)2, в то время как предшественниками P являются H3PO4, Na2HPO4 и (NH4)2HPO4. Репрезентативные химические реакции для осаждения nHA приведены ниже :
Просвечивающее электронное микроскопическое изображение наногидроксиапатита, полученного в результате процесса влажного химического осаждения . Воспроизведено с разрешения Elsevier, опубликовано Elsevier 2015.
Влияние значений рН раствора (9, 10 и 11) и температур спекания (300 °C и 900 °C) на морфологию nHA. []. Опубликовано Королевским обществом по лицензии Creative Commons Attribution ().
2.2. Оксид графена и его производные
Синтез GO и rGO хорошо описан в литературе, поэтому он кратко обсуждается здесь. Модифицированный процесс Хаммера является наиболее распространенным методом синтеза . В процессе графит и нитрат натрия диспергируются в серной кислоте.
Круглую колбу со смесью раствора погружают в ледяную баню при непрерывном перемешивании. За этим следует медленное добавление марганцовки. После этого суспензию разбавляют деионизированной водой. Реакция окисления прекращается добавлением большого количества воды и перекиси водорода. Реакционную смесь фильтруют, промывают HCl и деионизированной водой для удаления избытка соли марганца. Недостатками этого процесса являются образование токсичных газов (No2 и N2O4) из - за использования нитрата натрия и образования дефектных ГО. Кроме того, использование перманганата калия приводит к образованию следовых количеств Mn и Fe в GO, которые могут вызывать токсичность в клетках млекопитающих
Из литературы следует, что многие исследователи склонны использовать разное время и температуру окисления, а также различные типы и концентрации окислителей для синтеза GO.
В результате GOs обладают различным содержанием O или соотношением C/O, особенно те, которые получены с различным временем окисления. Скакалова использовала рентгеновскую фотоэлектронную спектроскопию (XPS) для оценки содержания кислорода в GOs,приготовленном по модифицированному методу Хаммерса с различными периодами окисления. Во время химического окисления в течение первых 60 мин деконволютированный спектр C-1s показывает основной пик около 284,7 эВ и небольшое плечо при 286,6 эВ, соответствующее sp2 углеродные и C–O–C-связанные виды, соответственно. Таким образом, поглощение кислорода в первой фазе ≈ 20 ат.% приводит к образованию C-O–C-связанных видов. Графитовая фаза (связь C–C при гибридизации sp 2) все еще сохраняется, таким образом, часть структуры частично интеркалируется кислородсодержащими видами. Поглощении кислорода поднимается выше на 30%, так как окисление происходит, и deconvoluted с-1С спектр показывает наличие СП3-гибридизированных С–С связи видов (285.6 эВ), С=О (287.6 ЭВ) и О–С=О (288.6 эВ) групп,
что предполагает полное окислительного интеркаляция (Б). После окисления в течение 4 дней структура интеркалированного графита становится нестабильной и самопроизвольно отслаивается на отдельные листы GO.
Длительное окисление в течение двух недель приводит к значительному снижению содержания кислорода с 30 до 20 ат.% из-за спонтанного высвобожденияCO2 []. Различные соотношения C/O в GOs приводят к большим различиям в их структурных свойствах,
о чем свидетельствуют различия в степени отслаивания, количестве и толщине слоя графена, поперечном размере, содержании функциональных групп и т.д. [].
А) Содержание кислорода в оксиде графена, определяемое методом рентгеновской фотоэлектронной спектроскопии в зависимости от времени окисления. (Б) Спектры XPS C-1s GO, сформированные в сильных окислителях в течение 0 мин, 30 мин (нижнее плато на панели А) и 120 мин (верхнее плато на панели А) []. Воспроизведено с разрешения Американского химического общества, опубликовано Американским химическим обществом, 2018.
Известно, что GO обладает функциональными группами кислорода, такими как карбоксильные, гидроксильные и эпоксидные, на базальной плоскости и на краю графенового листа. Таким образом, листы GO легко гидратируются в воде из-за наличия карбоксильных групп по краям. GO также может быть диспергирован в определенных органических растворителях, таких как N-метил-2-пирролидон (NMP), диметилформамид (DMF), тетрагидрофуран (THF) и этиленгликоль, благодаря наличию оксигенированных групп. Эти группы делают GO электроизоляционным, тем самым ограничивая его использование в электронной промышленности. Для восстановления его электропроводности для уменьшения перехода в rGO используются восстановители, такие как гидразин и борогидрид натрия. В целом, гидразин является наиболее часто используемым агентом из-за его хорошей восстановительной способности для удаления оксигенированных групп. Отмечается, что химическое восстановление GO в rGO не может полностью устранить оксигенированные группы. Оксигенированные группы также могут быть удалены в виде диоксида углерода путем быстрого нагрева до 1050 °C в вакууме или инертной атмосфере для получения термически восстановленного графена (TRG). Эта высокотемпературная обработка создает структурные дефекты в TRG в виде травильных отверстий в базальной плоскости графена.
Графеновые квантовые точки (GQD)-это углеродсодержащие наноматериалы 0D, обладающие низкой токсичностью, хорошей биосовместимостью, настраиваемым фотолюминесцентным эффектом и замечательным эффектом квантового удержания, что делает их
привлекательными для биомедицинских применений, например, для создания изображений, доставки лекарств, тканевой инженерии и т.д. GQD может быть получен из GO путем резки его графенового листа при гидротермальной обработке, гдедля окисления GO используются концентрированные H 2 SO4 и/или HNO3 . В процессе графеновый лист ГО разрезают смесью серной/азотной кислот под воздействием ультразвука. Затем обработанную суспензию переносят в нагретый автоклав для образования GQDs.
Совсем недавно Чжао и др. полученные GQDs диспергируют GO и KO2 в деионизированной воде при перемешивании. Затем суспензию переносили в автоклав и нагревали при 200 °C в течение 24 ч.
С помощью KO2можно было достичь коэффициента конверсии ≈ 35 мас.% из GO в GQDs. GQDs отображал желтую излучающую фотолюминесценцию, которая была полезна для визуализации клеток и определения рН .
Для изготовления GQDs было использовано несколько методов химической подготовки, таких как расщепление с помощью микроволновой печи, сольвотермическая резка и электрохимический метод. Например, Ли и др. подготовленные GQD путем расщепления
ПРОХОДЯТ в кислых условиях. Процессы расщепления и восстановления осуществлялись одновременно с использованием микроволнового облучения. Хаккарайнен и его коллеги использовали гидротермальный метод с использованием микроволновой
печи для получения GQD из бумаги, богатой целлюлозой. Бумагу пропитывали разбавленной серной кислотой с последующим микроволновым нагревом при 180 °C в течение 2 ч.
Схематические иллюстрации процедуры гидротермальной резки для GO с помощью KO2 для формирования графеновых квантовых точек с желтой фотолюминесценцией. Воспроизведено с разрешения Elsevier, опубликовано Elsevier, 2017.
2.3. Оксид графена-Наногидроксиапатит
GO и nHA могут быть одновременно добавлены к биоразлагаемым полимерам с образованием гибридных бионанокомпозитов. Гибриды GO/nHA демонстрируют замечательные улучшения в механических характеристиках и остеокондуктивности благодаря высокому модулю упругости GO и отличной биосовместимости nHA. GO и nHA могут быть синтезированы на месте для получения нанокомпозитов GO/nHA. Rodríguez-Gonzalez et al. приготовленный GO/nHA путем гидротермальной обработки водного раствора, содержащего GO, Ca(NO3)2, (NH4)2HPO4 и NH4OH при 90 °C. В процессе ГО был уменьшен до rGO при гидротермальной обработке. Li et al. синтезированный нанокомпозит GO/nHA путем добавления Ca(NO3)2 в водный раствор GO с последующим регулированием рН раствора до 10 аммиачной водой . Затем (NH4)раствор 2 HPO 4 по каплям добавляли в суспензию при интенсивном перемешивании, в течение которого рН поддерживали на уровне 10 путем титрования аммиачной водой. Продукт реакции окончательно выдерживали при 37 °C в течение 24 ч
Механизм образования GO/nHA был приписан электростатическому взаимодействию между GO и nHA. Отрицательно заряженные карбоксильные группы на краях базальной плоскости GO притягивают катионы Ca2+.
Таким образом, атомы Ca были благоприятно адсорбированы на краях. Впоследствии анионы HPO42− были привлечены катионами Ca2+ посредством электростатического взаимодействия, тем самым образуя на краях плоскости в процессе старения.
Аналогично, нанокомпозиты rGO/nHA также могут быть изготовлены аналогичным образом, поскольку rGO все еще содержит функциональные группы остаточного кислорода. Совсем недавно Не и др. приготовленный нанокомпозит rGO/nHA путем смешивания GO и nHA под
воздействием ультразвука с образованием однородной суспензии с последующей гидротермальной обработкой при 200 °C для индуцирования самосборки. Самосборка-это процесс, в котором отдельные компоненты организуются в упорядоченную структуру благодаря электростатическим взаимодействиям между компонентами. Затем GO преобразуется в rGO во время термической обработки. Таким образом, GO эффективно восстанавливается до rGO без использования токсичного восстановителя, такого как гидразин.
Предложенный механизм синтеза гидроксиапатита in situ на первозданных листах оксида графена []. Воспроизведено с разрешения Королевского химического общества, опубликовано Королевским химическим обществом, 2013.
а) Сканирующий электронный микроскоп и (б) изображения в просвечивающем электронном микроскопе GO/nHA. Вставка в (а) показывает изображение GO/nHA с высоким увеличением.
Воспроизведено с разрешения Королевского химического общества, опубликовано Королевским химическим обществом, 2013.
Нанокомпозит rGO/nHA, полученный из самосборки для репарации костных дефектов []. Воспроизведено с разрешения Elsevier, опубликовано Elsevier, 2017.
3. Получение полимерных бионанокомпозитных каркасов
Каркасы для инженерии костной ткани должны быть совместимыми, биоразлагаемыми, биоактивными, высокопористыми, с взаимосвязанной сетью пор и хорошей механической прочностью для поддержки роста костной ткани, переноса питательных веществ и удаления метаболических отходов, как упоминалось ранее (). [,,]. Эти каркасы могут быть получены с помощью широкого спектра методов, включая литье в растворителе/выщелачивание порогена, вспенивание газа, сублимационную сушку, разделение фаз, вызванное термическим воздействием, отжим расплава или мокрого отжима и электроспиннинг []. Каждая техника имеет свои преимущества и ограничения. Обычное изготовление пористых каркасов, такое как литье растворителем/выщелачивание порогеном, включает растворение полимера в органическом растворителе с последующим смешиванием с порогенами (например, солью, сахаром). Затем раствор полимера разливают в нужные формы, позволяя растворителю испариться и оставляя после себя полимерный/порогенный материал. Наконец, вода используется для растворения порогенов. Размер и фракции пор в каркасах контролируются фракциями порогенов []. Основными недостатками этого метода являются использование растворителя, длительное время замачивания в воде для выщелачивания порогенов и ограниченная толщина мембраны (3 мм). Вспенивание газа может создать пористую структуру в присутствии газа под давлением, такого как углекислый газ, что исключает использование токсичных растворителей []. В этом процессе используется сверхкритический газ CO2, действующий в качестве пластификатора и пенообразователя для получения пористых строительных лесов. В процессе вспенивания полимер насыщаетсяСО2 в сверхкритическом состоянии и плотным СО2 диффундирует и пластифицирует полимер за счет снижения его температуры стеклования (Tg). После насыщенияСО2 быстро сбрасывается давление, так что Tg начинает повышаться, и СО2 выходит из полимерной матрицы из-за быстрого падения давления. Это приводит к зарождению пузырьков и образованию пены. Недостатками этого метода являются плохой контроль взаимосвязанности пор и образование непористого слоя кожи на поверхности каркаса []. В технике сублимационной сушки водорастворимый полимер замораживают таким образом, что образуются взаимопроникающие кристаллы льда. Эти кристаллы льда удаляются сублимацией, в результате чего образуются пористые каркасы []. Термически индуцированное разделение фаз (TIPS) позволяет формировать взаимосвязанную пористую структуру. Он основан на изменении температуры для индуцирования фазового разделения однородного раствора полимер-растворитель путем демикширования твердой жидкости или разделения жидкой и жидкой фаз. Это приводит к образованию фазы, богатой полимерами, и фазы, бедной полимерами, при быстром охлаждении раствора полимерного растворителя; затем фаза, бедная полимерами, удаляется []. Несколько параметров, таких как типы полимеров и растворителей, концентрации полимеров и молекулярные массы, температуры и скорости охлаждения, могут влиять на морфологию и размер пор.
Откроется в отдельном окне
Необходимые свойства идеального каркаса для применения в инженерии костной ткани []. Воспроизведено с разрешения Elsevier, опубликовано Elsevier, 2017.
Волокнистые каркасы с большой площадью поверхности и относительно большой пористостью могут быть изготовлены с использованием расплава или мокрого прядения.
При прядении расплава полимер расплавляется и экструдируется через матрицу, имеющую множество небольших отверстий. Расплавленные волокна затем охлаждаются и затвердевают на воздухе. Полученные волокна
собираются с помощью приемного колеса для формирования непрерывных нитей волокна. Однако высокие температуры, используемые для плавления полимеров, препятствуют его использованию для инкапсуляции биоактивных соединений и клеток. Мокрое прядение включает растворение полимера в соответствующем растворителе с последующим экструзией раствора полимера через фильеру в коагуляционную ванну, содержащую нерастворитель.
Диаметры влажных пряденых нитей обычно находятся в диапазоне 30-600 мкм. Преимущества мокрого прядения включают внутреннюю более высокую пористость и больший размер пор .
Электроспиннинг является эффективным инструментом для получения микро - или нановолокон с использованием электрического поля для управления выбросом полимерной струи из иглы, прикрепленной к шприцу.
В процессе прикладываемое электрическое поле заряжает каплю полимера на кончике иглы, удерживаемую ее поверхностным натяжением.
При критическом напряжении капля вытягивается в конус Тейлора. Увеличивая электрическое поле выше критического значения, электростатическое отталкивание может преодолеть поверхностное натяжение капли.
Таким образом, полимерная струя вытягивается из кончика конуса
Тейлора в направлении заземленного коллектора. Когда струя движется в воздухе, она подвергается взбиванию и испарению растворителя. Нановолокна из электроспана со взаимосвязанной пористой структурой и большой площадью поверхности демонстрирую
т морфологическое сходство с естественным ECM. Добавляя nHA к биоразлагаемым полимерам, образующиеся волокнистые каркасы способствуют адгезии, росту и дифференцировке клеток .
Однако поры электроспановых каркасов довольно малы, обычно около 200-800 нм и менее 5 мкм, что ограничивает инфильтрацию костных клеток и рост сосудов.
В этом отношении взаимодействие клетки и каркаса ограничено только поверхностью. Как известно, костные ткани в значительной степени зависят от сосудистой сети для доставки питательных веществ, кислорода и метаболических отходов.
Таким образом, отсутствие контроля размера пор и связанная с этим васкуляризация ограничивают широкое использование электрошпун-ковриков для клинических применений.
Быстрое прототипирование (RP), также известное как аддитивное производство (AM), стало эффективным инструментом для печати 3D-пористых каркасов с четко определенной и воспроизводимой архитектурой с использованием широкого спектра материалов.
Кроме того, эта технология позволяет изготавливать 3D-объекты со сложной геометрией для конкретных пациентов. Каркасы AM могут быть изготовлены различными способами, такими как стереолитография (SLA), селективное лазерное спекание,
моделирование плавленого осаждения (FDM) и т.д. SLA с высоким разрешением использует литографический метод для фотокроссовки жидких полимерных смол, например, акриловых и эпоксидных смол с помощью УФ-лазера. Алифатические полиэфиры
, как правило, не содержат биоразлагаемых фотореактивных групп для сшиванияСистема AM обычно оснащена системой автоматизированного проектирования (САПР) для обработки высокопористых 3D-каркасов с управляемой архитектурой в послойном режиме.
Желаемая область имплантата пациента сканируется с помощью рентгеновского снимка или компьютерной томографии, и данные преобразуются в CAD-систему. Например, при селективном лазерном спекании (SLS) используется управляемый компьютером
CO2 лазерный луч для селективного плавления и спекания порошков полимерных композиционных материалов послойным способом для создания 3D-каркаса.
Преимущества SLS для формирования полимерных каркасов, включая универсальность материала и способность создавать объекты сложной формы []. Однако изделия SLS с зернистой поверхностью страдают от усадки и деформации из-за тепловых искажений.
FDM является наиболее широко используемым материалом на основе экструзии и обладает преимуществами простоты, гибкости, низкой стоимости и простоты изготовления без использования токсичных органических растворителей.
В FDM термопластичная нить направляется в разжижитель для плавления через ролики с последующим послойным прессованием с использованием сопла с компьютерным управлением.
Качество 3D-печатных объектов в значительной степени зависит от параметров FDM, включая температуру сопла, диаметр сопла, скорость экструзии, толщину слоя, угол растра и т.д. []. FDM страдает от необходимости подачи предварительно
сформованных полимерных волокон через ролики и сопло для плавления. Альтернативно, метод AM, основанный на экструзии полимерного раствора, может быть использован для изготовления биоактивных тканей или каркасов, нагруженных клетками.
Этот метод не требует процесса нагрева, что позволяет включать клетки и биоактивные молекулы. Для этой цели было разработано несколько экструзионных установок, включая электромагнитную, пневматическую и механическую (поршневую или винтовую) системы
Каркас 3D-печати []. Воспроизведено с разрешения Elsevier, опубликовано Elsevier, 2019.
В последние годы процесс 3D-печати чернилами широко используется в промышленном секторе для изготовления оптоэлектронных и электронных пленок . В настоящее время 3D-биопечать нашла потенциальное применение в областях тканевой инженерии, регенеративной медицины и фармацевтики. 3D-печать чернилами включает послойное нанесение биоматериалов с пространственным контролем функциональных компонентов с использованием жидких чернил, как показано на . Например, Якус и др. приготовили чернила путем простого смешивания суспензии
графена и полилактида-со-раствор гликолида. Эти чернила могут быть использованы для печати полимерных/графеновых каркасов с помощью системы 3D-печати на основе экструзии. Используя подход к инкапсуляции клеток, пористые 3D-каркасы формируются путем точной
совместной печати биоинков из множества материалов, состоящих из полимеров, живых клеток, генов, факторов роста и внеклеточных матриц. Кроме того, стволовые клетки могут легко адаптироваться к тканям, поэтому они являются привлекательным вариантом для биопечати костных тканей .
Недавний прогресс технологии 3D-биопечати предлагает возможный способ решения проблем васкуляризации . Однако 3D-биопечать также имеет определенные ограничения, поскольку она статична и учитывает только начальное состояние печатаемого объекта.
С быстрым развитием нанотехнологий совсем недавно была разработана четырехмерная (4D) биопечать, включающая конформационные изменения в печатных структурах. Включив время в качестве четвертого измерения и объединив стратегии 3D-биопечати, печатные
объекты могут изменять свою форму или функциональные возможности со временем под действием приложенного внешнего стимула (например, магнитного поля. 4D печать может быть разработана также без использования нанотехнологий, используя другие свойства полимеров для достижения памяти формы.
3.1. Нанокомпозиты на основе PLA
3.1.1. Нанокомпозиты PLA-nHA
Обработка и свойства нанокомпозитов PLA/nHA
Алифатические полиэфиры, такие как PLA, PGA, PLGA и PCL, нашли полезные применения в тканевой инженерии, такие как разлагаемые швы, устройства для фиксации костей, стенты и т.д..
Например, PLA с медленной скоростью деградации обычно используется для долговременных костных пластин и винтов . Однако PGA с быстрой скоростью деградации в основном используется для наложения швов и носителей доставки лекарств
. Как правило, сложные полиэфиры разлагаются в результате гидролитического расщепления цепи или расщепления их сложноэфирной связи, что приводит к снижению их молекулярной массы. На скорость гидролиза влияет несколько факторов, включая температуру, молекулярную
структуру и гидрофильность/гидрофобность полимеров. PGA представляет собой полукристаллический полимер, имеющий высокую температуру плавления в диапазоне 225-230 °C и Tg в диапазоне 35-40 °C. Из-за его простой химической структуры и стереорегулярности степень его кристалличности варьируется от полностью аморфной до 46-50% . PGA является гидрофильным с низкой растворимостью в органических растворителях. Таким образом, он быстро разлагается в водном растворе. PLA имеет высокую температуру плавления 173-178 °C, Tg 60-65 °C, модуль упругости 2,7–3,8 ГПа и предел прочности при растяжении в диапазоне 48-110 МПа []. PLA-это хиральный полимер, имеющий различные стереоизомеры. К ним относятся поли(l-лактид) [PLLA], поли(d-лактид) [PDLA] и поли(dl-лактид) [PDLLA] с различными физическими, механическими и биодеградационными свойствами. Изотактические PLLA и PDLA являются кристаллическими, в то время как атактическая PDLA является аморфной, не имеющей точки плавления. PLLA чаще используется в биомедицинских приложениях, чем PDLA.
Стереоизомер PLLA в этом обзоре называется PLA. PLA более гидрофобен, чем PGA, из-за наличия метильной группы в его молекулярной структуре. Соответственно, его сложноэфирная связь более устойчива к гидролизу из-за стерического препятствия со стороны метильной группы. Таким образом, PLA разлагается медленнее, чем PGA, высвобождая молочную кислоту во время гидролиза. Для регулирования скорости гидролиза синтезируют сополимеры PLA и PGA с образованием PLGA, физические свойства которых в значительной степени зависят от соотношения молочной кислоты (LA) к гликолевой кислоте (GA). PLGA обычно является аббревиатурой для поли d,l-молочной-со-гликолевой кислоты, где формы d- и l- молочной кислоты находятся в равном соотношении. Сополимер с соотношением LA к GA 80:20 является полукристаллическим. Когда соотношение мономера LA/GA увеличивается, скорость разложения сополимера соответственно уменьшается. Аморфный сополимер получают в соотношении 25 LA:75 GA. Сополимеры PLGA с различным соотношением LA/GA коммерчески доступны для биомедицинских применений в различных формах, включая сетку, каркас, гидрогель и шов []. PCL представляет собой полукристаллический полимер с низкой температурой плавления (58-63 °C), очень низким Tg (-60 °C) и низким модулем упругости 0,4 ГПа. PCL гидрофобен и разлагается гораздо медленнее, чем PLA, благодаря своей высококристаллической структуре. Скорости деградации алифатических полиэфиров уменьшаются в следующем порядке: PGA > PDLLA >> PLLA >>> PCL
PLA может быть получен из возобновляемых сельскохозяйственных ресурсов, т. е. молочной кислоты, полученной из кукурузного крахмала, и процесс включает микробную ферментацию. PLA используется в клиническом секторе в качестве каркасов и
устройств для фиксации переломов, однако при использовании PLA в ортопедии может возникнуть ряд проблем. Например, гидролитическое высвобождение молочной кислоты вызывает местную воспалительную реакцию, приводящую к снижению клеточной адгезии и пролиферации клеток.
PLA обладает малой биоактивностью для биоинвазивного осаждения и остеокондуктивности из-за своей гидрофобной природы. Присущая ПЛА хрупкость и низкая прочность ограничивают его использование. Тем не менее, эти недостатки могут быть преодолены путем включения nHA и включения в PLA для формирования бионанокомпозитов. В целом, nHA способствует адгезии и пролиферации остеобластов на своей поверхности а также способствует дифференцировке мезенхимальных стволовых клеток человека (HMSC) в направлении линии остеобластов .
Кроме того, добавление наночастиц щелочной кислоты в PLA может нейтрализовать кислую среду за счет гидролитического высвобождения молочной кислоты. Аналогичным образом, CVD-графеновый лист и GO также способствуют росту и дифференцировке стволовых клеток в различные линии .
Это делает GO эффективным наполнителем для регенерации костной ткани.
Майкл и др. Формованные под давлением нанокомпозиты PLA/nHA, содержащие содержание nHA от 1 до 5 мас.%, с модифицирующими поверхность агентами или без них []. В отсутствие модификаторов поверхности прочность на растяжение нанокомпозита PLA/1 мас.% nHA выше, чем у чистого PLA. Выше 1 мас.% nHA прочность нанокомпозитов PLA/nHA на растяжение значительно снижается из-за агломерации nHA и плохой адгезии на поверхности между nHA и PLA. При обработке поверхности nHA 3-аминопропилтриэтоксисиланом (APTES) заметно повышается прочность нанокомпозитов PLA/nHA на растяжение.
Обработка и свойства строительных лесов PLA/nHA
Пористые полимерные каркасы должны обладать достаточной механической прочностью и модулем упругости для поддержания клеточной адгезии и роста. Кроме того, они должны иметь большой размер пор и большой объем пор для инфильтрации и пролиферации клеток. Однако полимерные каркасы с высоким уровнем пористости и большими порами, как правило, обладают низкой механической прочностью и жесткостью []. Поэтому включение nHA в пористые каркасы может значительно улучшить их механические характеристики.
Котапалли и др. изготовили каркасы PLA/nHA, содержащие от 10 до 50 мас.% nHA, с использованием процесса литья растворителем/выщелачивания солью []. Пористость каркаса PLA постепенно уменьшалась с увеличением содержания nHA (а). Включение nHA в каркасы PLA заметно повысило его модуль сжатия и прочность. Модуль сжатия каркаса PLA составлял 4,7 МПа и достигал 9,8 МПа при 50 мас.% nHA. Прочность на сжатие каркаса PLA составила 0,29 МПа и увеличилась до 0,44 МПа при добавлении 50 мас.% nHA (б). Улучшенные механические характеристики каркасов PLA/nHA объяснялись слабым ионно-дипольным взаимодействием между кислородом в сложноэфирной группе PLA (C=O) и кальцием в nHA. В этом отношении приложенное напряжение может эффективно передаваться от матрицы PLA к наполнителям nHA во время испытаний на сжатие. Вэй и Ма использовали СОВЕТЫ для приготовления каркасов PLA/nHA, содержащих 10-70 мас.% nHA, путем разделения фаз при -18 °C с использованием диоксана []. Морфология пористых каркасов PLA и PLA/50 мас.% nHA приведена на a–c соответственно, показывая функцию пор, похожую на лестницу. Поровая структура каркасов была создана в результате разделения фаз раствора диоксанта. Растворитель (диоксант) кристаллизуется при закалке до криогенной температуры и становится порами после сублимации []. Они также сообщили, что добавки nHA улучшили модуль сжатия строительных лесов PLA. Неджати и др. также приготовлены пористые каркасы PLA и PLA/50 мас.% nHA с использованием процесса TIPS. В этих каркасах также наблюдалась лестничная морфология пор []. Механические свойства строительных лесов PLA и PLA-nHA перечислены в .
а) Изображения SEM с низким и (b) высоким увеличением чистого каркаса PLA, полученные методом термически индуцированного разделения фаз. (c) Микрофотография SEM каркаса PLA/50 мас.% nHA []. Воспроизведено с разрешения Elsevier, опубликовано Elsevier, 2004.
Таблица 1
Средние структурные и механические свойства пористых каркасов, полученных из алифатических полиэфиров и их нанокомпозитов, армированных нанонаполнителями nHA или GO.
| Состав образца, мас.% | Маршрут изготовления | Пористость, % | Размер пор, мкм | Диаметр волокна, нм | Способ Механических Испытаний | Модуль упругости, МПа | Прочность, МПа | Удлинение, % | Ссылка. |
|---|---|---|---|---|---|---|---|---|---|
| Строительные леса на основе PLA | |||||||||
| НОАК | SC/PL | 92.0 | NA | Нет | Компрессия | 4.7 | 0.29 | NA | [] |
| PLA/10% nHA | SC/PL | 91.4 | NA | Нет | Компрессия | 5.0 | 0.32 | NA | [] |
| PLA/20% nHA | SC/PL | 90.6 | NA | Нет | Компрессия | 6.4 | 0.35 | NA | [] |
| PLA/50% nHA | SC/PL | 86.5 | NA | Нет | Компрессия | 9.8 | 0.44 | NA | [] |
| НОАК | Советы | 93.0 | 50–100 | Нет | Компрессия | 4.3 | NA | NA | [] |
| PLA/10% nHA | Советы | 92.8 | 50–100 | Нет | Компрессия | 4.9 | NA | NA | [] |
| PLA/30% nHA | Советы | 92.3 | 50–100 | Нет | Компрессия | 7.8 | NA | NA | [] |
| PLA/50% nHA | Советы | 91.8 | 50–100 | Нет | Компрессия | 8.3 | NA | NA | [] |
| НОАК | Советы | 87.4 | 175 | Нет | Компрессия | 2.4 | 1.79 | NA | [] |
| PLA/50% nHA | Советы | 85.1 | 175 | Нет | Компрессия | 14.9 | 8.67 | NA | [] |
| НОАК | ES | NA | 4.51 | 365 | Напряжение | 0.42 | 0.063 | 27 | [] |
| PLA/5% nHA | ES | NA | 1.32 | 255 | Напряжение | 1.80 | 0.157 | 30 | [] |
| PLA/20% nHA | ES | NA | 0.53 | 135 | Напряжение | 4.71 | 0.262 | 36 | [] |
| PLA | LAM | 55.3 | 271 | None | Tension; Bending | 2.8 (B) | 42.5 (T); 122.8 (B) | NA | [] |
| PLA/10% nHA | LAM | 68.5 | 336 | None | Tension; Bending | 3.1 (B) | 38.6 (T); 131.9 (B) | NA | [] |
| PLA/20% nHA | LAM | 85.1 | 392 | None | Tension; Bending | 3.5 (B) | 35.1 (T); 138.6 (B) | NA | [] |
| PLA/30% nHA | LAM | 76.3 | 354 | None | Tension; Bending | 3.8 (B) | 29.2 (T); 119.1 (B) | NA | [] |
| PLA/40% nHA | LAM | 72.2 | 318 | None | Tension; Bending | 3.9 (B) | 23.2 (T); 112.5 (B) | NA | [] |
| НОАК | ES | NA | NA | 839 | Напряжение | NA | 2.1 | 97 | |
| PLA/1% GO | ES | NA | NA | 706 | Напряжение | NA | 2.9 | 85 | |
| PLA/2% ИДУТ | ES | NA | NA | 863 | Напряжение | NA | 3.5 | 87 | |
| PLA/1% GO-g-PEG | ES | NA | NA | 593 | Напряжение | NA | 3.9 | 95 | |
| PLA/2% GO-g-PEG | ES | NA | NA | 761 | Напряжение | NA | 4.5 | 83 | |
| PLA/5% GO-g-PEG | ES | NA | NA | 685 | Напряжение | NA | 5.2 | 84 | |
| НОАК | ES | 70.5 | NA | 786 | Напряжение | 8.58 | 0.27 | NA | [] |
| PLA/15% nHA | ES | 74.5 | NA | 563 | Напряжение | 9.88 | 0.41 | NA | [] |
| PLA/15% nHA-1% GO | ES | 75.6 | NA | 516 | Напряжение | 12.69 | 0.47 | NA | [] |
| PLA/15% nHA-2% GO | ES | 76.2 | NA | 502 | Напряжение | 16.73 | 0.57 | NA | [] |
| PLA/15% nHA-3% GO | ES | 77.9 | NA | 412 | Напряжение | 8.10 | 0.38 | NA | [] |
| Строительные леса на основе PCL | |||||||||
| PCL | ES | NA | 1.94 | 393 | Напряжение | NA | 12.3 | 380 | [] |
| PCL/30% nHA | ES | NA | 2.19 | 317 | Напряжение | NA | 85.17 | 530 | [] |
| PCL/60% nHA | ES | NA | 2.30 | 332 | Напряжение | NA | 158.1 | 564 | [] |
| PCL | SLS | 63.1 | 1750 × 1750 | NA | Компрессия | 65 | 3.2 | NA | [] |
| PCL | SLS | 79.0 | 2000 × 2500 | NA | Компрессия | 54 | 2.0 | NA | [] |
| PCL | SLS | 78.54 | NA | NA | Компрессия | NA | 1.38 | NA | [] |
| PCL/10% nHA | SLS | 72.06 | NA | NA | Компрессия | NA | 2.67 | NA | [] |
| PCL/15% nHA | SLS | 70.31 | NA | NA | Компрессия | NA | 3.17 | NA | [] |
| PCL | ES | 94.1 | NA | 543 | Напряжение | 10.5 | 2.37 | 110 | [] |
| PCL/0,3% GO | ES | 94.6 | NA | 640 | Напряжение | 17.4 | 4.61 | 275 | [] |
| Трабекулярная кость; высушенная обезжиренная | NA | NA | NA | NA | Компрессия | 1.1–139 | 0.3–7.0 | NA | [] |
| Трабекулярная кость; свежезамороженная | NA | NA | NA | NA | Компрессия | 1.4–79 | 1.5–45 | NA | [] |
Откроется в отдельном окне
Abbreviations: B, three-point bending; ES, electrospinning; LAM, low temperature additive manufacturing; NA, not available; PL, porogen leaching; SC, solvent casting; SLS, selective laser sintering; T, Tension; TIPS, thermally induced phase separation.
Как известно, ECM состоит из волокнистых структур, состоящих из белковых молекул. Исследователи приложили много усилий для изготовления каркасов, которые могут имитировать наноструктурные особенности ECM для содействия регенерации тканей. Это может быть достигнуто с помощью метода электрошпиннинга. а,б показаны типичные SEM-изображения каркасов PLA из электрошпиннинга и PLA/15 мас.% nHA. Включение 15 мас.% nHA в PLA уменьшает диаметр его волокон (c,d) []. Чжон и др. применено электрошпинирование для изготовления композитных каркасов PLA/5 мас.% nHA и PLA/20 мас.% nHA []. Они сообщили, что добавки nHA значительно повышают модуль Юнга, прочность на растяжение и пластичность PLA при растяжении. Таким образом, nHA с модулем упругости 110 ГПа может придать жесткость PLA с низким модулем 2,7–3,8 ГПа . Относительное удлинение PLA при растяжении увеличивается с 27% до 30% и 36% при добавлении 5 мас.% и 20 мас.% nHA соответственно ().
Как упоминалось выше, электроспановые каркасы с небольшими размерами пор препятствуют проникновению клеток и врастанию костной ткани []. Как правило, большие макропоры (200-400 мкм) способствуют миграции остеобластов и остеопрогенераторов в каркасы и способствуют образованию и минерализации тканей []. Однако пористые каркасы с большими порами, высоким уровнем пористости и взаимосвязанными порами невозможно хорошо контролировать с помощью обычных методов изготовления. Соответственно, 3D-печать стала привлекательным подходом для формирования 3D-каркасов с контролируемой пористостью и большим размером пор [,]. В частности, FGM является наиболее распространенным методом печати аккуратных каркасов PLA []. Полученный каркас имел размер пор 500 мкм и пористость 60%. Хуан и др. применена технология низкотемпературного аддитивного производства (LAM) для печати каркасов PLA/nHA с различным содержанием nHA, т. е. 10, 20, 30 и 40 мас.% nHA при -20 °C []. PLA обычно не обладает термической стабильностью при высокой температуре обработки, поэтому низкотемпературная печать может избежать быстрой деградации PLA. Параметры пор и механические свойства этих каркасов приведены в . Каркас PLA/20 мас.% nHA имеет самый высокий уровень пористости 85,1% и самый большой размер пор 392 мкм. Размер пор этого каркаса достаточно велик для адгезии, инфильтрации и пролиферации остеобластных клеток. Corcione et al. сначала были подготовлены нити PLA/nHA с последующей печатью 3D-каркасов с использованием FDM []. Из морфологии SEM и результатов испытаний на сжатие было установлено, что nHA равномерно диспергируется в матрице PLA каркасов PLA/nHA, тем самым улучшая механические свойства PLA.
3.1.2. Нанокомпозиты PLA/GO
Обработка и свойства нанокомпозитов PLA/GO
Оксид графена с более высоким модулем упругости более эффективен, чем nHA, для придания жесткости PLA. GO с большой площадью поверхности и насыщенными кислородом функциональными группами взаимодействует с PLA через водородную связь, что приводит к его равномерному диспергированию в матрице PLA, тем самым образуя нанокомпозиты PLA/GO с улучшенной механической прочностью при низком содержании наполнителя. Пинто и др. сообщается, что добавление 0,4 мас.% GO к PLA значительно увеличивает его модуль упругости и прочность на растяжение []. Арриагада и др. сообщается, что GOS более эффективны, чем TRGs, в повышении модуля растяжения PLA. Оксигенированные группы GOs обеспечивают однородное диспергирование нанонаполнителей в матрице PLA []. В целом, прочная связь наполнитель-полимер облегчает эффективную передачу напряжений от полимерной матрицы к наполнителям во время механических испытаний. Таким образом, наполнители могут эффективно выдерживать приложенные нагрузки, что приводит к заметному повышению механической прочности полимерных нанокомпозитов. Прочная связь наполнителя с матрицей может быть дополнительно достигнута в нанокомпозитах PLA/GO либо путем добавления компатибилизатора [], либо путем прививки поверхности GO группами PLA или PEG []. В последнем случае Ли и др. привитый GO с PLA для получения GO-g-PLA, а затем смешанный с PLA для образования PLA/GO-g-Нанокомпозиты PLA с использованием процесса литья в растворителях []. При добавлении 0,5 мас.% GO-g-PLA прочность на растяжение PLA увеличивается с 35 МПа до 72 МПа (увеличение на 105,7%), в то время как удлинение при разрыве PLA увеличивается с 6,50 до 14,48% (улучшение на 122,8%).
Совсем недавно Хаккарайнен и его коллеги изготовили плотный нанокомпозит PLA/GQD путем добавления 0,05 мас.% GQD (46 нм) с использованием метода коагуляции раствора (а, б) []. Они сообщили, что GQD были равномерно распределены в матрице PLA из-за точечного контакта, созданного между соседними GQD в результате их небольшого размера, и взаимодействия между насыщенными кислородом группами GQD и PLA. Следовательно, прочность на растяжение и относительное удлинение при растяжении нанокомпозита PLA/0,05 мас.% GQD были значительно выше, чем у PLA и PLA/0,05 мас.% GO (c). Кроме того, GQDs с более высокой гидрофильностью значительно ускорили деградацию PLA.
а) TEM-изображение графеновых квантовых точек (GQDs). b) Атомно-силовой микроскоп (АСМ) изображение PLA/GQDs, показывающее однородную дисперсию GQDs в матрице PLA. с) Кривые напряжения–деформации PLA, PLA/0,05 мас.% GO и PLA/0,05 мас.% GQD []. Воспроизведено с разрешения Американского химического общества, опубликовано Американским химическим обществом, 2016.
В последние годы технология FDM все чаще используется для печати образцов полимеров на растяжение для оценки их механических характеристик []. Для достижения высокой гибкости печатной продукции Chen и др. объединили термопластичный полиуретан (TPU), PLA и GO (0,5, 2 и 5 мас.%) для печати твердых образцов FDM с высокой прочностью и гибкостью []. TPU-это эластомер с очень гибкими и прозрачными свойствами, совместимый с живыми клетками. Таким образом, сочетание PLA и TPU в различных концентрационных соотношениях может привести к образованию пластичных и гибких полимерных смесей, подходящих для применения в тканевой инженерии. В процессе печати нанокомпозитные нити сначала получают путем смешивания всех составляющих материалов в органических растворителях с последующим испарением растворителя, сушкой и экструзией. Полученные нити затем направляются роликами в принтер FDM для изготовления растяжимых стержней. Чен и др. продемонстрировано, что добавление 0,5 мас.% GO в смесь TPU/PLA 70/30 в значительной степени улучшает модуль растяжения и прочность, а также термостабильность нанокомпозита. Средний модуль растяжения и предел текучести TPU/PLA 70/30 с FDM-печатью составляют 45,56 МПа и 6,65 МПа соответственно. При добавлении 0,5 мас.% GO средний модуль растяжения и предел текучести увеличиваются до 79,96 МПа и 11,25 МПа соответственно. Средняя деформация при разрыве TPU/PLA 70/30 составляет 717% и снижается до 602% при добавлении 0,5 мас.% GO ().
а) Модуль растяжения при моделировании плавленого осаждения-печатная смесь термопластичного полиуретана (TPU)/PLA и ее нанокомпозитов с различными нагрузками GO. b) Кривые растягивающего напряжения–деформации печатной смеси TPU/PLA и ее нанокомпозитов с различными нагрузками GO []. Воспроизведено с разрешения Американского химического общества, опубликовано Американским химическим обществом, 2017.
Обработка и свойства строительных лесов PLA/GO
Совсем недавно Мао и др. подготовленные электрошпунные коврики PLA/GO с различной концентрацией GO []. Добавки GO заметно улучшают механические свойства и термостойкость нановолокнистых матов. Чжан и др. привитые поверхности ИДУТ с ПЭГОМ, чтобы усилить его межфазное сцепление с PLA. Затем они ввели нанонаполнители GO и GO-g-PEG в PLA для формирования волокнистых каркасов из электроспана . Диаметр PLA уменьшается с 839 нм до 706 нм при добавлении 1 мас.% GO, но увеличивается до 863 нм за счет добавления 2 мас.% GO. По сравнению с каркасами PLA, волокна PLA/GO-g-Каркасы для колышков имеют более мелкие диаметры. Как правило, два конкурирующих фактора обработки могут влиять на диаметры электрошлифованных композитных каркасов, т. е. на вязкость и электропроводность раствора полимера. Высокая проводимость раствора приводит к образованию тонких волокон, в то время как большая вязкость раствора приводит к образованию грубых волокон. Электропроводность раствора PLA составляет 1,19 мкс·см−1. Проводимость увеличивается до 2,08 мкс·см−1 и 2,70 мкс·см−1 при добавлении 1 мас.% GO и 2 мас.% GO соответственно . Твердая пленка GO, как правило, известна как электрический изолятор. Однако его оксигенированные группы придают ему отрицательный поверхностный заряд в растворе. Проводимость раствора зависит от наличия ионов в растворе. Таким образом, проводимость растворов PLA/GO увеличивается с увеличением содержания GO. Вязкость растворов PLA/GO также увеличивается с увеличением содержания наполнителя, как и ожидалось. Таким образом, эффект проводимости является доминирующим фактором в уменьшении среднего диаметра PLA/1 мас.% GO. Между тем, увеличение среднего диаметра PLA/2% GO можно объяснить значительным увеличением вязкости раствора в результате добавления 2 мас.% GO. а показаны кривые растягивающего напряжения–деформации каркасов PLA/GO и PLA/GO-g-PEG из электрошпуня. По-видимому, ГО-г-Нанополнители PEG более эффективны, чем GO, в повышении прочности на растяжение PLA при той же загрузке наполнителя. Привитые цепи PEG GO могут усиливать дисперсию наполнителя в матрице PLA и межфазное взаимодействие между GO и PLA. Прочность на растяжение PLA составляет 2,1 МПа и увеличивается до 2,9 МПа при 2 мас.% GO, в то время как до 4,5 МПа при 2 мас.% GO-g-PEG. Отмечается, что оба нанополнителя привели лишь к незначительному снижению относительного удлинения композитных каркасов при растяжении. Диаметры волокон и свойства на растяжение каркасов PLA/GO и PLA/GO-g-PEG приведены в . Теперь мы рассмотрим влияние добавок GQD на свойства PLA при растяжении. Хаккарайнен и его коллеги ввели 1-5 мас.% GQD в каркасы PLA во время электрошпиннинга []. По сравнению с PLA, значительное повышение модуля упругости и прочности на растяжение может быть достигнуто за счет добавления GQDs. Эти параметры растяжения увеличиваются с увеличением содержания GQD (б).
а) Кривые растягивающего напряжения–деформации электрошпунных лесов PLA, PLA/GO и PLA/GO-g-PEG. с разрешения Elsevier. b) Кривые растягивающего напряжения–деформации электрошпунных каркасов PLA и PLA/GQD. [], MDPI по лицензии Creative Commons Attribution (CC BY) ().
3.1.3. Гибридные нанокомпозиты PLA/nHA-GO
Обработка и свойства гибридных нанокомпозитов PLA/nHA-GO
Совсем недавно Чен и др. изготовили плотные гибридные нанокомпозитные пленки PLA/nHA-GO с использованием процесса коагуляции []. В процессе нитрат кальция и дигидрофосфат аммония диспергировали в растворе имитированной жидкости организма (SBF) с последующим добавлением водного раствора GO. Микроволновое облучение использовалось для нагрева смешанного раствора для получения nHA-GO с 1 мас.% GO. Чистый nHA также был приготовлен с использованием тех же условий обработки (). Компактные пленки PLA/nHA-GO с содержанием наполнителя от 10 до 30 мас.% были изготовлены путем медленного опускания этанольной суспензии nHA-GO в PLA/дихлорметан (DCM) с последующей коагуляцией. Коагулированные продукты в конечном итоге были прессованы в плотные тонкие пленки. Для сравнения также были подготовлены пленки PLA/(10-30 мас.%) nHA без ГО. Результаты испытаний на растяжение показали, что наполнители nHA-GO были более эффективными, чем nHA, в повышении модуля растяжения, прочности на растяжение и относительного удлинения при разрыве PLA (). Модуль растяжения, прочность на растяжение и относительное удлинение компактной пленки PLA составили 1303 ± 108 МПа, 58,6 ± 2,7 и 6,2 ± 0,4% соответственно. При добавлении 20 мас.% nHA значения этих параметров растяжения составили 2293 ± 142 МПа, 39,6 ± 3,9 МПа и 5,0 ± 0,4% соответственно. Добавление 20 мас.% nHA привело к повышению модуля упругости и прочности при растяжении за счет пластичности при растяжении. Путем включения 20 мас.% гибрида nHA-GO в PLA было получено дальнейшее повышение свойств при растяжении. Этерификация между карбоксильной группой GO и гидроксильной группой nHA привела к значительному улучшению свойств пленок PLA/nHA-GO при растяжении. Сообщалось, что модуль растяжения, прочность и относительное удлинение при разрыве пленки PLA/20 мас.% nHA-GO составили 3513 ± 182 МПа, 93,2 ± 4,9 МПа и 7,4 ± 0,8% соответственно. Растягивающие свойства полученного в результате PLA и его нанокомпозитов лучше, чем у губчатой кости человека, имеющей модуль упругости и предел прочности при растяжении 67 МПа и 54 МПа соответственно []. Таким образом, эти материалы с сопоставимой прочностью на растяжение с губчатой костью могут быть использованы в качестве несущих фиксирующих устройств для лечения репарации костей.
Схема, показывающая синтетические стратегии для nHA и nHA-GO при микроволновом нагреве. Коагуляция раствора и прессование были использованы для изготовления плотных пленок PLA/nHA и PLA/nHA-GO []. Воспроизведено с разрешения Американского химического общества, опубликовано Американским химическим обществом, 2018.
Кривые напряжения–деформации плотных нанокомпозитных пленок PLA/nHA-GO, демонстрирующих повышенную прочность на растяжение и пластичность. Нанокомпозитные пленки PLA/nHA с 10, 20 и 30 мас.% nHA были обозначены как HA10, HA20 и HA30 соответственно. Гибридные пленки PLA/nHA-GO с 10, 20 и 30 мас.% nHA-GO обозначались как HG10, HG20 и HG30 соответственно []. Воспроизведено с разрешения Американского химического общества, опубликовано Американским химическим обществом, 2018.
Обработка и свойства гибридных строительных лесов PLA/nHA-GO
Пористые каркасы, изготовленные из одного материала, как правило, трудно удовлетворить требованиям тканевой инженерии из-за присущих им ограничений свойств материала, например, хрупкости керамических наполнителей, плохой остеоиндукции алифатических полиэфиров из-за выделения кислых продуктов разложения. В этом контексте объединение двух или более типов нанополнителей очень эффективно для создания каркасов из костной ткани с улучшенными механическими характеристиками и хорошей биосовместимостью. В последнее время различные полимерные бионанокомпозиты могут быть созданы путем добавления двух нанонаполнителей со значительно различными физическими и химическими свойствами в одну полимерную матрицу []. Соответственно, новые гибридные полимерные нанокомпозиты с индивидуальными свойствами могут быть разработаны за счет использования комбинированных преимуществ различных нанонаполнителей. Ожидается, что, унаследовав хорошую биосовместимость nHA и высокую жесткость GO, полученные нанокомпозиты PLA/nHA-GO будут обладать превосходной биоактивностью, остеокондуктивностью и высокой механической прочностью.
Чонг и его коллеги подготовили электрошпун PLA/15 мас.% nHA-(1-3 мас.%) ИДУТ строительные леса []. Результаты показали, что гибридное добавление 1 мас.% GO или 2 мас.% GO к PLA/15 мас.% nHA увеличивает его модуль растяжения и прочность, особенно заметное увеличение модуля упругости. При 3 мас.% GO как модуль растяжения, так и прочность PLA/15 мас.% nHA-3% GO заметно снизились из-за агломерации нанонаполнителей ().
3.2. Нанокомпозитные каркасы на основе PLGA
Поли(гликолевая кислота) демонстрирует быструю скорость разложения в физиологических растворах, что препятствует ее клиническому применению. В этом контексте PGA всегда сополимеризуется с PLA в различных концентрациях лактида/гликолида, чтобы получить PLGA с промежуточными скоростями деградации между PLA и PGA. Обычное литье растворителем/выщелачивание частиц (SC/PL) предполагает использование органических растворителей, которые вредны для биологических клеток и тканей. Чтобы решить эту проблему, Ким и др. объединили вспенивание газа и выщелачивание твердых частиц (GF/PL) для получения каркасов PLGA/nHA без использования органических растворителей []. Каркасы GF/PL демонстрировали взаимосвязанные пористые структуры и превосходную механическую производительность по сравнению с каркасами, изготовленными методом SC/PL. Хосе и др. получены электроспановые нанокомпозитные каркасы PLGA с 1, 5, 10 и 20 мас.% nHA []. Они сообщили, что модуль хранения (определенный на основе динамического механического анализа) строительных лесов увеличился с 441 МПа для чистого PLGA до 724 МПа для 5 мас.% nHA. Дальнейшее увеличение содержания наполнителя приводит к снижению модуля хранения, например, 371 МПа для 20 мас.% nHA, из-за агломерации наполнителя при высокой загрузке наполнителя. Общеизвестно, что свойства эле решений, в том числе полимера, концентрация, вязкость раствора, растворителя, электропроводности, поверхностного натяжения и молекулярного веса полимера, и технологические параметры, такие как напряжение, спиннинг температура, скорость потока, частота вращения, иглы для коллекционера расстояние и т. д., повлиять на морфологии electrospun волокон значительно [,]. Ло и др. приготовили суспензию из 15 мас.% PLGA или 18 мас.% PLGA с 1% ГО путем их диспергирования в смешанном растворителе, состоящем из тетрагидрофурана (THF) и ДМФ []. Суспензию PLGA/GO затем подвергали электрообработке для получения волокнистых матов. Они сообщили, что углы соприкосновения с водой 15%-PLGA и 18%-PLGA нановолокнистых ковриков уменьшились со 123 ± 4° до 115 ± 4° и со 122 ± 4° до 111 ± 4°, соответственно, при добавлении 1 мас.% GO. Таким образом, происходит незначительное снижение гидрофобного поведения PLGA.
Совсем недавно Fu и др. продемонстрировали, что добавки 10 мас.% nHA, 2 мас.% GO и 10 мас.% nHA + 2 мас.% GO в волокнистый каркас PLGA (75/25) могут уменьшить угол контакта с водой <90°, особенно для добавления GO []. Угол контакта с водой нановолокнистого мата PLGA составлял 104,1 ± 5,2° и уменьшился до 95,2 ± 1,9° и 86,9 ± 6,9° при добавлении 10 мас.% nHA или 2 мас.% GO, соответственно. Кроме того, угол соприкосновения дополнительно уменьшен до 74,4 ± 3,5° для гибридного каркаса PLGA/10 мас.% nHA-2 мас.% GO. Было выражено благотворное влияние GO на уменьшение угла контакта гидрофобной PLGA. Этот эффект возникает из–за присутствия гидрофильных групп OH, C–O-C и COOH на поверхности GO []. Учитывая механические свойства, включение 10 мас.% nHA в PLGA увеличило его прочность на растяжение с 2,72 МПа до 3,02 МПа. При добавлении 2 мас.% GO прочность на растяжение PLGA дополнительно увеличилась до 5,98 МПа. Максимальная прочность на растяжение была достигнута за счет включения 10 мас.% nHA + 2% гибридных нанонаполнителей GO в матрицу PLGA.
3.3. Нанокомпозиты на основе PCL
3.3.1. Нанокомпозиты PCL/nHA
Свойства нанокомпозитов PCL/nHA
PCL, обладающий высокой степенью кристалличности и плохой гидрофильностью, демонстрирует очень медленную скорость деградации, что ограничивает его применение в области инженерии костной ткани. Скорость его деградации может быть изменена путем добавления гидрофильных нанонаполнителей nHA, GO или гибридных нанонаполнителей nHA/GO. Мойни и др. приготовленный на месте нанокомпозит PCL/20 мас.% nHA путем растворения PCL в ацетоне при перемешивании с последующим добавлением Ca(OH)2 и H3O4 в полимерный раствор. Смешанный раствор обрабатывали в сольвотермических условиях []. Нанокомпозит PCL/HA был отлит на чашку Петри и высушен в течение 24 ч при комнатной температуре. Модуль растяжения и прочность на растяжение литой пленки PCL составляют 106 ± 6 МПа и 9,3 ± 0,3 соответственно. Модуль растяжения литой пленки PCL несколько меньше, чем у PCL, смешанного с расплавом (т. е. 337 МПа) []. Это может быть связано с образованием небольшого количества пор внутри литой пленки PCL в результате испарения растворителя. При добавлении 20 мас.% nHA к PCL модуль растяжения и прочность на растяжение увеличиваются до 126 ± 4 МПа и 11,8 ± 0,2 МПа соответственно. Кроме того, модуль сжатия и прочность на сжатие пленки PCL составляют 160,8 ± 7 МПа и 15 ± 0,2 МПа, в то время как у пленки PCL/20 мас.% nHA составляют 241,6 ± 12 МПа и 19 ± 0,4 МПа соответственно. По-видимому, добавление 20 мас.% nHA к PCL улучшает его механические характеристики. Эшраги и Дас использовали SLS для изготовления объемной пленки PCL []. Модуль растяжения объемного PCL составлял от 343,9 до 364,3 МПа, в то время как его предел прочности при растяжении составлял от 10,5 до 16,1 МПа. Кроме того, модуль сжатия объемного PCL колебался от 297,8 до 317,1 МПа, а прочность на сжатие составляла 38,7 МПа.
Структура и свойства пористых каркасов PCL/nHA
Мойни и др. также приготовлена пористая PCL/20 мас.% нанокомпозитная основа nHA с пористостью >90% методом литья растворителем/выщелачивания частиц [>]. Наличие пор с размерами в диапазоне 10-200 мкм в каркасе привело к резкому снижению модуля сжатия с 241,6 ± 12 МПа до 1,99 ± 0,076 МПа и прочности на сжатие с 19 ± 0,4 МПа до 159 ± 7 кПа. Совсем недавно Li и др. изготовили электроспановые маты PCL/nHA с высокой нагрузкой nHA 30 мас.% и 60 мас.% для содействия инфильтрации костных клеток []. Угол контакта PCL с водой составлял 135,4° и уменьшился до 134,1° и 131,8° за счет добавления 30% nHA и 60% nHA соответственно. Размер пор электроспанового PCL-мата составлял 1,94 мкм и немного увеличился до 2,19 мкм и 2,30 мкм при добавлении 30% nHA и 60% nHA соответственно. Li и др. продемонстрировали, что добавки nHA значительно повышают прочность на растяжение и относительное удлинение при растяжении PCL. Мат PCL имел прочность на растяжение 12,3 ± 0,89 МПа и увеличился до 85,17 ± 2,61 МПа и 158,1±12,6 МПа соответственно за счет включения 30% и 60% nHA в PCL. Кроме того, относительное удлинение при растяжении PCL, PCL/30% nHA и PCL/60% nHA составило 380%, 530% и 564% соответственно. Из этих данных видно, что размеры пор электроспанового PCL и его нанокомпозитных каркасов очень малы для инфильтрации костных клеток.
Метод AM является эффективным инструментом для изготовления 3D-каркасов PCL и PCL/nHA с четко определенными макропорами для клеточной инфильтрации []. SLS обычно используется для изготовления каркасов PCL из-за его хорошей обрабатываемости в результате низкой температуры плавления (58-63 °C) и температуры стеклования (-60 °C) []. Механические свойства при сжатии строительных лесов, изготовленных из SLS, в значительной степени зависят от конструкции строительных лесов. Уильямс и др. продемонстрировали, что подготовленные SLS каркасы PCL могут быть легко адаптированы к сложным анатомическим местоположениям. Значения модуля сжатия и предела текучести 3D PCL-каркасов варьируются от 52 до 67 МПа и от 2,0 до 3,2 МПа для расчетной пористости >63% соответственно [>]. Ся и др. применена технология SLS для изготовления каркасов PCL/(5-15%) nHA цилиндрической формы с размерами пор от 600 до 800 мкм []. Добавки nHA были полезны для повышения гидрофильности PCL. Угол контакта PCL с водой составлял 112,98° и резко уменьшился до 87,42°, 81,00° и 79,50° за счет добавления 5 мас.%, 10 мас.% и 15 мас.% nHA соответственно к PCL. Поэтому большие размеры пор и гидрофильное поведение каркасов PCL/nHA способствовали адгезии, пролиферации и инфильтрации HMSC. Кроме того, наполнители nHA также были очень эффективны в повышении прочности на сжатие обработанного SLS PCL. Прочность на сжатие PCL составила 1,38 ± 0,16 МПа и увеличилась до 2,67 ± 0,20 МПа и 3,17 ± 0,11 МПа при добавлении 10 мас.% nHA и 15 мас.% nHA соответственно.
Из литературы следует, что для печати 3D PCL и каркасов PCL/nHA использовалась система печати на основе экструзии []. Хуан и др. использовали как наполнители nHA, так и наполнители β-трикальцийфосфата (TCP) (10 и 20 мас.%) для усиления нанокомпозитных каркасов 3D PCL/nHA и PCL/TCP. Как признано, материал бета-TCP находит привлекательное применение в качестве заменителя кости в ортопедии благодаря своей хорошей биосовместимости и биодеградации. Их результаты показали, что все каркасы демонстрируют четко определенную архитектуру пор с равномерным распределением пор. Размеры пор каркасов PCL, PCL/nHA и PCL/TCP находились в диапазоне 287 и 317 мкм []. Кроме того, как наполнители nHA, так и наполнители TCP увеличили прочность на сжатие каркасов PCL. Добавки 20 мас.% nHA и 20 мас.% TCP увеличили модуль сжатия каркасов PCL с 48,08 ± 0,09 МПа до 75,72 ± 0,57 МПа и 88,07 ± 1,91 МПа соответственно. Очевидно, что модуль сжатия 3D-печатного каркаса PCL/20 мас.% nHA значительно выше, чем у отлитого в растворителе каркаса PCL/20 мас.% nHA (1,99 ± 0,076 МПа) []. Кроме того, обработанный SLS PCL/15 мас.% nHA обладает значительно более высокой прочностью на сжатие (3,17 ± 0,11 МПа), чем у отлитого в растворителе каркаса PCL/20 мас.% nHA (159 ± 7 кПа) []. По сравнению с обычными процессами изготовления каркасов, похоже, что методы 3D AM могут создавать механически прочные и стабильные каркасы с четко определенной пористой структурой для применения в инженерии костной ткани.
Кьеллини и его коллеги использовали технологию AM для изготовления каркасов с двойной пористостью на микро - и макроуровнях на основе мокрого отжима растворов PCL, PCL/nHA, star-PCL и star-PCL/nHA []. Используя тот же подход, Ким и др. сконструированные 3D-каркасы PCL и PCL/(10-20 мас.%) nHA с макро-и микропористыми структурами с помощью 3D-графики на основе нерастворительного разделения фаз (NIPS). Этот метод создает макропоры между волокнами каркаса на основе печатного дизайна и микропоры в волокнах путем разделения фаз в растворах PCL/HA по механизму обмена нерастворитель/растворитель []. В процессе nHA диспергируют в PCL/THF, и суспензию экструдируют в ванну с этанолом (EtOH) с помощью сопла. Нить была нанесена послойно в последовательности 0°/90° для получения макропор с квадратной геометрией ( и ). Микропоры в нитях создаются путем разделения фаз путем обмена растворителем (THF) и нерастворителем (EtOH). Микропоры в нитях имитируют структуру человеческих костей, тем самым обеспечивая эффективные места для адгезии клеток и переноса питательных веществ []. Поэтому формирование иерархической структуры в печатных 3D-каркасах, состоящих из макропор и микропор, значительно облегчает остеокондукцию и остеоинтеграцию in vivo []. Ширина нити накала и пористость PCL составляют 219 ± 16 мкм и 78,4 ± 1,2 мкм соответственно, в то время как у PCL/10 мас.% nHA 270 ± 3 мкм и 77,04 ± 3,5 мкм соответственно. А,Б представлены репрезентативные изображения SEM, показывающие равномерно распределенные микропоры внутри нитей PCL или нитей PCL/nHA.
Экспериментальная установка для 3D-печати каркасов с макро - и микропорами на основе нерастворителя с разделением фаз (NIPS). [], MDPI по лицензии Creative Commons Attribution (CC BY) ().
SEM-изображения поперечного сечения 3D-печатных каркасов PCL/nHA на основе NIPS с различными нагрузками nHA: (А) 0 мас.%, (Б) 10 мас.%, (В) 15 мас.% и (Г) 20 мас.%. [], MDPI по лицензии Creative Commons Attribution (CC BY) ().
SEM-изображения микропор, сформированных в нитях 3D-печати на основе NIPS (А) PCL и (B) PCL/10 мас.% строительных лесов. [], MDPI по лицензии Creative Commons Attribution (CC BY) ().
Отмечается, что специфические формы пор 3D-печатных каркасов влияют на их механические и биологические свойства []. Другими словами, архитектура или схема расположения нитей влияет на механическое поведение и адгезию клеток печатных каркасов. Каркас PCL с простым рисунком 0/90° обычно имеет квадратные взаимосвязанные поры, как показано на а. Изменяя угол осаждения слоя до 0/60/120° и 0/45/90/135°, получают каркасы с треугольной и сложной внутренней геометрией пор []. Печатные 3D-каркасы с ортогональной конструкцией слоя с ориентацией 0/90°, как правило, обеспечивают лучшие механические характеристики по сравнению с другой архитектурой слоя осаждения. Строительные леса с рисунком 0/90° демонстрируют более высокий модуль сжатия и прочность на сжатие, чем те, которые получены для моделей 0/60/120° и 0/45/90/135°. Модуль сжатия каркасов PCL с узорами 0/90°, 0/60/120° и 0/45/90/135° на расстоянии нити (от центра до центра нитей) 650 мкм составляет 34,2 ± 3,8 МПа, 30,5 ± 4,5 МПа и 19,1 ± 2,8 МПа соответственно [].
3.3.2. Нанокомпозиты PCL/GO
Свойства нанокомпозитов PCL/GO
В последние годы GO превратился в важную группу наполнителей для полимеров для формирования структурных и функциональных полимерных нанокомпозитов благодаря заметному улучшению их механических и электрических свойств при низких нагрузках наполнителя. Включение GO в полимерную матрицу с низким модулем может привести к значительному усилению []. Ван и Чен приготовили твердые пленки PCL/GO с различными нагрузками GO 0,3–2 мас.% путем литья в растворителе с последующим прессованием для получения плотных твердых пленок []. Установлено, что нанонаполнители GO эффективно укрепляют и укрепляют PCL. При добавлении 0,3 мас.% GO модуль упругости, прочность на растяжение и относительное удлинение при растяжении PCL увеличились с 209 ± 21 МПа, 14,2 ± 1,6 МПа и 554 ± 72% до 230 ± 30 МПа, 25,1 ± 4,1 МПа и 802 ± 65% соответственно. По сравнению с контролем чистого PCL модуль упругости и прочность на растяжение PCL были увеличены на 10% и 77% соответственно за счет добавления 0,3 мас.% GO. При увеличении содержания GO до 2 мас.% модуль упругости и предел прочности при растяжении дополнительно увеличились до максимальных значений 442 ± 35 МПа и 27,5 ± 5,7 МПа соответственно, но относительное удлинение при растяжении снизилось до 548 ± 81%. Усиливающий эффект GO на PCL был обусловлен образованием водородной связи между GO и PCL, что подтверждено инфракрасной спектроскопией с преобразованием Фурье (FTIR), и однородной дисперсией GO в матрице PCL.
Как уже упоминалось, GO является электрическим изолятором, и его электропроводность может быть восстановлена путем добавления восстановителей для получения rGO. Путем включения rGO в PCL полученные нанокомпозиты демонстрируют хорошую электропроводность. Сайяр и др. сообщается, что добавки rGO улучшают электропроводность и механическую прочность PCL []. Кумар и др. изучено влияние добавок GO, rGO и функционализованных аминами GO (AGO) (1, 3 и 5 мас.%) на динамическое механическое поведение, смачиваемость и реакцию стволовых клеток на прессованные диски PCL. Они сообщили, что модуль хранения при 25 °C PCL увеличивается с увеличением загрузки наполнителя, и это увеличение было наибольшим для GO, за которым следуют AGO и rGO []. Таким образом, нанокомпозиты PCL/rGO имели наименьший модуль хранения из-за слабых взаимодействий между PCL и rGO. Модуль хранения полимеров при 25 °C рассматривался как их модуль упругости. Кроме того, добавки GO и AGO улучшили смачиваемость PCL, т. е. повысили его гидрофильность. Однако добавление нанонаполнителей rGO с небольшим количеством функциональных групп, насыщенных кислородом, увеличило гидрофобность PCL, что привело к увеличению угла контакта композитов PCL/rGO.
Свойства пористых каркасов PCL/GO
Ван и Чен также изготовили каркас GO из электроспана PCL/0,3 мас.% и сообщили, что наполнитель GO увеличивает прочность на растяжение, модуль упругости и энергию при разрыве PCL на 95%, 66% и 416% соответственно. Модуль упругости и прочность на растяжение electronspun PCL составили 10,5 ± 0,92 МПа и 2,37 ± 0,09 МПа и увеличились до 17,4 ± 1,25 МПа и 4,61 ± 0,15 МПа, соответственно, за счет добавления 0,3 мас.% GO []. Модуль упругости и прочность на растяжение были увеличены на 66% и 95% соответственно. Недавно Сонг и др. изготовили серию электрошпунных ковриков PCL/GO, содержащих 0,1, 0,3, 0,5 и 1,0 мас.% GO []. При добавлении 0,1 мас.% и 0,3 мас.% GO к PCL растягивающее напряжение и модуль упругости электроспановых нанокомпозитных каркасов были выше, чем у чистого PCL. При содержании GO ≥0,5 мас.% значения этих параметров растяжения резко снижались из-за агрегации наполнителя. Улучшение механических свойств электроспановых каркасов было связано с однородной дисперсией GO в матрице PCL, высокой жесткостью GO и взаимодействиями между GO и PCL. Недавно Рамазани и Карими включили нанонаполнители rGO и GO в PCL с последующим электроспинингом []. Добавление 0,1 мас.% GO и 0,1 мас.% rGO в PCL привело к увеличению прочности на растяжение каркасов из PCL более чем на 160% и 304% соответственно и улучшению модуля Юнга более чем на 103% и 163% благодаря хорошей дисперсии обоих нанополнителей и их взаимодействию с PCL. Как уже упоминалось, rGO является электрическим проводником, поэтому включение rGO в PCL может создавать электропроводящие каркасы. Такие проводящие каркасы полезны для адгезии и пролиферации клеток, поскольку они могут стимулировать эффективную адсорбцию и осаждение сывороточных белков на их поверхности, тем самым способствуя прикреплению клеток и росту клеток [].
Небольшие поры, образующиеся в электроспановых каркасах PCL/GO и PCL/rGO, могут ограничивать проникновение клеток, как упоминалось ранее. Таким образом, 3D-печать является эффективным инструментом для изготовления каркасов на основе PCL с четко определенными макропорами []. Ван и др. используется для изготовления 3D-каркасов из ПКЛ/графена []. Их графеновые листы были изготовлены путем диспергирования графитовых хлопьев в органических растворителях методом ультразвукового отшелушивания. Этот процесс позволяет получать графеновые листы в больших количествах, и полученные графеновые листы называются жидкофазным отслоившимся графеном (LPE) []. Однако большинство органических растворителей, используемых для отслаивания чешуек графита, например, DMF и NMP, являются высокотоксичными, и удержание токсичных растворителей в листах LPE-графена может вызывать цитотоксичность. Этот вредный эффект ограничивает использование LPE-графена в приложениях биомедицинской инженерии. Тем не менее, добавки LPE-графена к 3D-печатным каркасам PCL могут помочь нам понять первозданные взаимодействия графена и клеток в проводящих полимерных каркасах. В их исследовании добавки LPE-графена (0,13, 0,50 и 0,78 мас.%) повышают гидрофильность 3D-печатных каркасов PCL/графена. Угол контакта каркаса PCL составлял 96,10° и уменьшился до 91,78°, 86,48° и 88,25° при добавлении 0,13, 0,50 и 0,78 мас.% LPE-графена соответственно.
3.3.3. Гибридный нанокомпозит PCL/nHA-GO
Чжоу и др. синтезированный гибрид nHA-GO посредством гидротермального процесса, а затем включающий 0,2%, 0,5%, 1% и 2% nHA-GO в PCL с использованием литья в растворителе []. а показывает, что стержни nHA плотно закреплены на поверхности графенового листа благодаря механизму самосборки []. Это приводит к сильным взаимодействиям между nHA и GO. Кроме того, GO преобразуется в rGO или графеновые листы (Gs) во время гидротермальной обработки, как показали результаты FTIR. Таким образом, насыщенные кислородом группы ГО в значительной степени удаляются гидротермальной обработкой. Соответственно, свойства при растяжении гибридов PCL/nHA-GO заметно улучшаются благодаря синергетическим эффектам между наполнителями. Для сравнения, GO также подвергают гидротермической обработке, смешивают с PCL, затем заливают растворителем, чтобы получить PCL/1 мас.% Gs. Прочность на растяжение и относительное удлинение при растяжении гибридов PCL/nHA-Gs выше, чем у гибридов PCL/1 мас.% Gs (б). Улучшение механических свойств гибридных нанокомпозитов можно объяснить сильными взаимодействиями между nHA и Gs и равномерной дисперсией гибридных наполнителей в матрице PCL.
а) ТЕМ изображение nHA-Gs, показывающее прикрепление nHA на графене. b) Прочность на растяжение и относительное удлинение при разрыве PCL и его нанокомпозитов []. Воспроизведено с разрешения Elsevier, опубликовано Elsevier, 2017.
4. Исследования In Vitro
4.1. Гидролитическая деградация In Vitro
Поведение при гидролитическом разложении алифатических полиэфиров и их нанокомпозитов обычно осуществляется путем погружения в физиологический раствор фосфатного буфера (PBS) при 37 °C []. Ege и др. изготовили плотный нанокомпозит PLGA и PLGA/25 мас.% nHA с использованием двухшнековой экструзии с последующим литьем под давлением []. Затем эти образцы были погружены в 0,01 М раствор PBS при 37 °C. Результаты показали, что PLGA имеет более высокую скорость деградации, за которой следует нанокомпозит PLGA/25 мас.% nHA. Хуан и др. изготовили нанокомпозит PLA/nHA путем смешивания расплава и погрузили чистый PLGA и нанокомпозит в PBS с рН 7,4 []. Они сообщили, что как прочность на изгиб, так и модуль упругости neat PLA ухудшаются быстрее, чем у образца нанокомпозита после погружения в PBS на срок до 20 недель. Соответственно, нанокомпозит может поддерживать достаточную механическую прочность для адгезии и роста костных клеток на ранней стадии разложения. Кроме того, высвобожденные ионы из nHA композита PLA/nHA могут нейтрализовать молочную кислоту, разлагающуюся из PLA в процессе деградации. В этом отношении эффект автокаталитической деградации кислот в PLA может быть существенно сведен к минимуму за счет добавления nHA, тем самым улучшая биоактивность PLA. Дуань и др. продемонстрировали, что оксигенированные группы GO улучшили смачиваемость нанокомпозитов PLA/(0,5–2 мас.% GO), тем самым ускоряя гидролитическую деградацию PLA в деионизированной воде, растворах HCl и NaOH. Чем выше содержание GO в нанокомпозитах, тем выше была скорость гидролитической деградации [].
Диас и др. изготовили каркасы PCL/nHA с 10 мас.%, 30 мас.% и 50 мас.% nHA путем сублимационной сушки композитных суспензий []. С помощью этого процесса были получены пористые каркасы с пористостью до 90%. Чистые PCL и нанокомпозитные каркасы погружали в PBS при 37 °C в течение длительных периодов времени. Перед погружением в раствор модуль сжатия нанокомпозитных каркасов увеличивается с увеличением содержания nHA (а). После погружения модуль сжатия всех образцов уменьшается с увеличением времени погружения. После 5 недель погружения жесткость каркасов PCL/30 мас.% nHA и PCL/50 мас.% nHA выше, чем у чистых каркасов PCL и PCL/10 мас.% nHA (б). Аналогичная тенденция снижения сжимающего напряжения со временем наблюдается для всех образцов (не показано). c показывает, что потеря веса чистого каркаса PCL медленно увеличивается с увеличением времени погружения. Во время погружения вода проникает в аморфную фазу PCL, что приводит к набуханию и разрыву цепи сложноэфирной связи. PCL обладает высококристаллической структурой и гидрофобностью, что препятствует поглощению воды и приводит к небольшой потере веса. Напротив, нанокомпозитные каркасы подвергаются большей потере веса, особенно при более высоких нагрузках на структуру (c). Водопоглощение каркасов PCL/nHA заметно увеличивается со временем погружения за счет включения гидрофильных наполнителей nHA (d). По-видимому, добавки nHA ускоряют скорость деградации PCL с плохой способностью к разложению. Совсем недавно Санчес-Гонсалес и др. изучено поведение гидролитической деструкции высокопористого PCL и каркаса PCL/0,1 мас.% rGO, полученного методом фазовой инверсии []. Оба типа каркасов были погружены в PBS при 37 °C в течение 12 месяцев. Высокая внутренняя пористость каркасов облегчала проникновение воды, что приводило к расщеплению молекулярных цепей PCL. Присутствие rGO несколько ускорило скорость деградации.
Откроется в отдельном окне
(а) Модуль сжатия против Содержание nHA в композитных каркасах PCL/nHA перед испытанием на погружение. Деградационные свойства композитных каркасов PCL/nHA: (b) модуль сжатия в зависимости от времени деградации, (c) потеря веса в зависимости от времени деградации и (d) поглощение воды в зависимости от времени деградации. [], Хиндави по лицензии Creative Commons Attribution.
4.2. Биоминерализация
Биоактивность пористых каркасов можно оценить путем осаждения слоя апатита на их поверхности путем инкубации в моделируемой жидкости организма (SBF) с ионными концентрациями, аналогичными концентрациям в плазме крови человека []. Синтетический апатит является высоко биорезорбируемым материалом, обладающим отличной биоактивностью и биосовместимостью []. Было обнаружено, что минерализованные каркасы усиливают остеобластическую активность, остеогенную дифференцировку и формирование костей по сравнению с необработанными аналогами []. Образование слоя апатита на полимерах и композитах в значительной степени зависит от ионных концентраций (0,2–2 SBF) растворов SBF и составов материалов []. Чжан и Ма сообщили, что кристаллы апатита покрывают поверхность PLA после инкубации в SBF в течение 15 дней. Они предположили, что отрицательно заряженные ионы COO, полученные из PLA, притягивают положительные ионы Ca2+ из SBF, тем самым индуцируя зарождение апатита [249]. Однако для испытания на минерализацию SBF требуется длительное время погружения для нанесения слоя апатита на поверхность образца. Следовательно, время погружения может быть уменьшено за счет использования более высоких концентраций ионов в SBF. Чен и др. сообщается, что апатитовое покрытие может быть сформировано на PLA, погруженном в пересыщенный 5 SBF в течение 24 ч [].
Tjong и коллеги указали, что наполнители nHA из нанокомпозита PLA/18 мас.% nHA, смешанного с расплавом, играют важную роль в зарождении слоя апатита на его поверхности при погружении в раствор SBF []. Толщина слоя апатита увеличивается с увеличением времени погружения. Формирование слоя апатита включает диффузию и осаждение ионов Ca2+ из SBF и их электростатические взаимодействия с OH− и PO43− группами nHA. Райзер и др. исследовано влияние добавки nHA на формирование слоя апатита на электроспановом поли-l/dl-лактид/20 мас.% nHA-каркас при погружении в раствор SBF при 37 °C []. Поли-l/dl-лактид (P[L/DL]LA-сополимер, обычно используемый для устройств фиксации переломов и костных винтов. Они сообщили,что слой апатита не был нанесен на чистый каркас PLDL после 7-дневного погружения в раствор SBF (а, б). Однако круглые минеральные конкреции были нанесены на электрошпун PLDL/20 мас.% волокнистого мата nHA и полностью покрыли поверхность мата (c,d). Эти микрофотографии ясно показали, что наполнители nHA действуют как эффективные места зарождения минерализации.
SEM - изображения электрошпунных (a,b) PLDL и (c,d) PLDL/20 мас.% nHA-каркасов после 7-дневного погружения в 1,5 смоделированный раствор жидкости для тела (SBF). Воспроизведено с разрешения Springer, опубликовано Springer, 2014.
Было показано, что включение GO и GQD в алифатические полиэфиры также может индуцировать осаждение кристаллов апатита на их поверхности []. Оксигенированные группы GO, такие как карбоксильные (−COOH) и гидроксильные (−OH), обеспечивают активные сайты для биоминерализации []. Например, толстый слой минерала фосфата кальция может быть нанесен на поверхность мата из электроспана PCL/0,3 мас.% путем погружения в раствор 10 SBF при комнатной температуре в течение 20 ч []. Хаккарайнен и его коллеги продемонстрировали, что оксигенированные группы GQD способствуют осаждению кристаллов апатита на электроспановых каркасах PLA/GQD с 2,5 мас.% и 5 мас.% GQD. показывает SEM-изображения каркасов PLA и PLA/GQD с электрошпунем, соответственно. На этих микрофотографиях видно, что относительно меньше кристаллов апатита покрывают чистый каркас PLA. Однако протяженность и толщина кристаллов апатита растут с увеличением содержания GQD в каркасах PLA/GQD. В частности, более высокие количества минеральных отложений можно увидеть на поверхности PLA/5 мас.% GQD. По-видимому, добавление GQDs в каркасы PLA может способствовать остеокондуктивности за счет стимуляции как биоминерализации, так и адгезии/пролиферации остеобластов.
SEM-изображения электрошпунных ковриков PLA, PLA/1 мас.% GQD, PLA/2,5 мас.% GQD и PLA/5 мас.% GQD после минерализации в SBF в течение 24 дней. [], MDPI по лицензии Creative Commons Attribution (CC BY) ().
4.3. Культивирование Клеток In Vitro
4.3.1. Бионанокомпозиты
Дифференцировку остеобластов in vitro можно охарактеризовать тремя стадиями, включая пролиферацию клеток, созревание матрикса и минерализацию матрикса. Во время пролиферации остеобласты секретируют белки костного матрикса, включая коллаген 1 типа (Col I), остеопонтин и фибронектин. Остеобласты также продуцируют щелочную фосфатазу (ALP), т. е. ранний маркер дифференцировки остеобластов, при созревании ECM с ALP и коллагеном. Таким образом, повышенная активность ALP связана с прогрессирующей дифференцировкой остеобластов. Как известно, фосфатаза-это фермент, который гидролизует фосфатную группу из органического субстрата. п-нитрофенилфосфат обычно используется в качестве субстрата для исследования активности фермента фосфатазы. Продукт реакции, п-нитрофенол, желтеет в щелочных условиях. Продукт, полученный в результате ферментативной реакции, связан с активностью ALP, и его поглощение можно исследовать с помощью спектрофотометра. На последнем этапе происходит минерализация матрикса путем экспрессии остеокальцина, который способствует отложению минерала фосфата кальция []. Полимеразная цепная реакция в реальном времени (ОТ-ПЦР) является мощным инструментом для выявления экспрессии генов остеогенных маркеров, включая ALP, коллаген I типа (Col I), остеокальцин (OCN) и Runx2 []. Отложение кальция можно охарактеризовать окрашиванием красителем Alizarin red S и осмотром в фазово-контрастном микроскопе. Для количественного анализа осадок может быть извлечен и количественно оценен с помощью колориметрического анализа [].
Лок и др. приготовленный объемный нанокомпозит PLGA/30 мас.% nHA методом литья в растворителе. Затем они высевали HMSC на нанокомпозит с коротким пептидом BMP-7 или без него []. Они сообщили, что нанокомпозит PLGA/30 мас.% nHA способствует адгезии и дифференцировке hMSCs с остеогенными факторами или без них в культуральной среде. Недавно Кумар и др. культивированные HMSC на прессованных дисках PCL, PCL/GO, PCL/rGO и PCL/AGO, содержащих 1, 3 и 5 мас.% наполнителей. Затем они количественно проанализировали осаждение минеральной матрицы с помощью hMSCs с использованием красителя Alizarin red S []. В результате их исследования композиты PCL/GO и PCL/AGO показали значительно более высокое осаждение минералов, чем чистый PCL. Содержание минералов увеличивалось с увеличением нагрузок наполнителя GO или AGO. В частности, PCL/5 мас.% НАЗАД показал самое высокое осаждение минералов среди всех исследованных образцов. Они объяснили это наличием аминных групп на поверхности, что приводит к усилению остеогенеза и минерализации стволовых клеток. Другими словами, существует синергический эффект между аминными и оксигенированными функциональными группами на поверхности AGO в усилении остеогенеза HMSC [].
3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий бромид (МТТ) анализ обычно используется для изучения пролиферации клеток in vitro. Этот анализ измеряет клеточной пролиферации и жизнеспособности путем ферментативного превращения соли тетразолия до формазана нерастворимые в воде кристаллы, дегидрогеназ, происходящие в митохондриях живых клеток []. показывает МТТ результаты клеточной линии остеосаркомы (мг-63), культивируемых на ПЛА - /ПЛА и ня/ня-идут нанокомпозитов с 10-30 мас.% наполнителя содержание []. По-видимому, клетки остеобластов, культивируемые на чистой пленке PLA, демонстрируют самую низкую жизнеспособность из-за своего гидрофобного поведения и отсутствия биоактивных участков для адгезии клеток. Напротив, PLA/10 мас.% nHA и PLA/20 мас.% nHA демонстрируют более высокую жизнеспособность или пролиферацию клеток, чем чистый PLA. При 30 мас.% nHA жизнеспособность клеток несколько снижается в результате агломерации nHA при высокой загрузке наполнителя. По сравнению с аналогами PLA/nHA гибриды PLA/nHA-GO демонстрируют более высокую жизнеспособность клеток, особенно для пленки PLA/1 мас.% nHA-GO.
3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий бромид (МТТ) анализ клеток MT63, культивируемых на PLA и его нанокомпозитных пленках. Пленки PLA/nHA с 10, 20 и 30 мас.% nHA обозначались как HA10, HA20 и HA30 соответственно. Гибридные пленки PLA/nHA-GO с 10, 20 и 30 мас.% nHA-GO обозначались как HG10, HG20 и HG30 соответственно. Результаты выражаются в виде среднего ± стандартного отклонения []. Воспроизведено с разрешения Американского химического общества, опубликовано Американским химическим обществом, 2018.
4.3.2. Бионанокомпозитные каркасы
Бионанокомпозитные строительные леса с наполнителями nHA
Волокнистые каркасы из электроспана обладают рядом преимуществ для применения в инженерии костной ткани, включая высокую пористость, большую площадь поверхности для прикрепления клеток, а нановолокнистая сеть имитирует структурную особенность естественного ECM. Tjong и коллеги оценили адгезию и пролиферацию остеобластных клеток Saos-2 на электроспановых матах PLA, PLA/15 мас.% nHA и PLA/15 мас.% nHA-(1-3 мас.%) GO с использованием анализа MTT []. Анализ измеряет активность митохондрий на жизнеспособных клетках путем уменьшения соли МТТ до окрашенного нерастворимого формазана. a–c - типичные микрофотографии SEM, показывающие высев остеобластов на электрошпун PLA, PLA/15% nHA и PLA/15% nHA-2% волокнистых матов GO. На поверхности PLA-мата обнаружено очень мало остеобластов, поскольку на нем отсутствуют участки клеточной адгезии. Напротив, остеобласты прикрепляются, растут и распространяются по поверхности коврика PLA/15% nHA, поскольку наполнители nHA предлагают эффективные места для посева остеобластов. Было показано, что гидрофильные поверхности способствуют адсорбции клеточных белков, тем самым способствуя адгезии и росту клеток []. Наноматериалы nHA и GO могут индуцировать гидрофобный PLGA-мат до гидрофильного, уменьшая его угол контакта с водой <90°, особенно GO с обильными функциональными группами, насыщенными кислородом []. В этом отношении повышенная адгезия костных клеток происходит на волокнистом мате PLA/15% nHA-2% GO из-за синергического эффекта между наполнителями nHA и GO в индуцировании гидрофильности. Поверхность этого коврика широко покрыта остеобластами (в). а изображены результаты МТТ, показывающие жизнеспособность клеток Saos-2, посеянных на волокнистые маты PLA, PLA/15% nHA и PLA/15% nHA-(1-3)% GO. На 10-й день волокнистые маты PLA/15% nHA, PLA/15% nHA-1% GO и PLA/15% nHA-2% GO демонстрируют более высокую жизнеспособность клеток по сравнению с чистым матом PLA. Активность щелочной фосфатазы (ALP) репрезентативных волокнистых матов показана на b. ALP-это фермент, секретируемый остеобластами, который идентифицируется как ранний маркер дифференцировки остеобластов. По сравнению с чистым ковриком PLA, коврики PLA/15% nHA и PLA/15% nHA-1% GO демонстрируют гораздо более высокую активность ALP на 7-й и 14-й день. В целом, гибрид PLA/15% nHA-1 мас.% GO обладает самой высокой биосовместимостью in vitro.
SEM micrographs of osteoblasts seeded onto the surfaces of (a) PLA, (b) PLA/15 wt% nHA, and (c) PLA/15 wt% nHA-1 wt% GO mats. Reprinted from [], MDPI under the Creative Commons Attribution (CC-BY) license.
(a) MTT assay results of Saos-2 cell cultivated on PLA and its composite fibrous mats for 3, 7 and 10 days. * p < 0.05. (b) ALP levels of Saos-2 cell cultivated on PLA and its composite fibrous mats for 3, 7 and 14 days. * p < 0.05, ** p < 0.01. Reprinted from [], MDPI under the Creative Commons Attribution (CC-BY) license.
Чжан и др. изготовили спиральные каркасы PCL/nHA с различным содержанием nHA, т. е. массовыми соотношениями nHA: PCL 1:8, 1:4 и 1:2. Поры этих каркасов образовались в результате выщелачивания соли. Остеобласты плода человека (HFOB) культивировали на пористых каркасах PCL/nHA []. Они сообщили, что HFOB могут прилипать, проникать во взаимосвязанные поры спиральных каркасов с высокой жизнеспособностью клеток. Кроме того, активность ALP была заметно повышена с увеличением содержания nHA в спиральных каркасах PCL/nHA. Кроме того, nHA способствовал образованию минерализованной матрицы на каркасах PCL/nHA, как показано окрашиванием Arizarin red S (). Отложение кальция HFOB во внеклеточном матриксе является показателем остеогенеза и может рассматриваться как маркер регенерации костной ткани. Морелли и др. сообщалось, что электроспан PLA/20 мас.% nHA mat индуцировал остеогенную дифференцировку HMSC и остеокластогенную дифференцировку, о чем свидетельствует высокая экспрессия специфических генных маркеров, таких как остеопонтин, остеокальцин, ALP и активатор рецептора ядерного фактора каппа В (РАНГ) []. Ремоделирование кости-это динамичный процесс, включающий резорбцию старой кости остеокластами и формирование новой костной ткани остеобластами.
Откроется в отдельном окне
Окрашивание ализариновым красным S кальция, нанесенного на спиральные каркасы PCL/nHA. А) Остеобласты человеческого плода, культивируемые на аккуратных спиральных каркасах PCL, (B) Спиральный каркас PCL/nHA с nHA:PCL = 1:8, (C) Спиральный каркас PCL/nHA с nHA:PCL = 1:4 и (D) Спиральный каркас PCL/nHA с nHA:PCL = 1:2 в течение 21 дня. (E) Количественный анализ количества кальция в каждом спиральном каркасе. Данные представляют собой среднее ± стандартное отклонение, n = 6. Значимые различия между различными группами материалов были обозначены как * (p [], PLOS по лицензии Creative Commons Attribution.
Бионанокомпозитные строительные леса с наполнителями GO
Сообщалось, что графен и его производные очень эффективны в стимулировании остеогенной дифференцировки мезенхимальных стволовых клеток []. Лян и др. сообщалось, что добавление 1,5 мас.% GO к каркасу PLGA/nHA усиливает пролиферацию остеобластов мыши (MC3T3-E1) []. Ло и др. изучали влияние добавок GO на пролиферацию и остеогенетическую дифференцировку hMCSs на электрошпунных матах PLGA []. Они сообщили, что нанонаполнители GO играют две решающие роли в волокнистых матах, т. е. повышают гидрофильность и ускоряют адгезию, пролиферацию и остеогенную дифференцировку hMSCs. Результаты анализа MTT, показывающие пролиферацию МСК, культивируемых на 15 мас.% PLGA, 18 мас.% PLGA, и их нанокомпозитных волокнистых матах в течение различных периодов времени, приведены на а. При добавлении 1 мас.% GO в обе суспензии PLGA полученные композитные волокнистые маты демонстрируют повышенную адгезию и пролиферацию МСК. b–d показывает результаты анализа ОТ-ПЦР для этих волокнистых матов с дексаметазоном или без него (DEXA). Дифференцировка HMSC в линии остеобластов in vitro связана с их способностью экспрессировать Col I и ALP. Col I экспрессируется остеобластами в начальный период пролиферации и синтеза ECM, в то время как ALP экспрессируется в постпролиферативный период созревания матрикса []. Остеогенная дифференцировка HMSC in vitro значительно усиливается DEXA. В присутствии DEXA количества ALP, OCN и Col I, извлеченные из HMSC, культивируемых на нанокомпозитных матах 15-PLA/1% GO и 18-PLA/1% GO, существенно выше, чем количества, культивируемые на каркасах 15-PLGA и 18-PLGA. Это указывает на то, что нанонаполнители GO очень эффективны для стимулирования дифференцировки стволовых клеток. В целом, во многих экспериментах со стволовыми клетками in vitro часто используют ДЕКСУ, аскорбиновую кислоту и β-глицерофосфат для повышения уровня экспрессии остеогенных клеток []. DEXA индуцирует дифференцировку МСК в остеобласты путем активации Runx2, аскорбиновая кислота увеличивает секрецию Col I, а β-глицерофосфат служит источником фосфата в гидроксиапатите [].
(a) MTT assay showing the proliferation of human mesenchymal stem cells (hMSCs) cultured on tissue culture plate (TCP), electrospun PLGA copolymers and their nanocomposite scaffolds with or without dexamethasone (DEXA), for 14 and 28 days, respectively; (* p < 0.05). Real time polymerase chain reaction (RT-PCR) analysis of osteogenic marker genes of hMSCs seeded on electrospun PLGA copolymers and their nanocomposite scaffolds with or without DEXA, for 14 and 28 days, respectively: (b) Alkaline phosphatase (ALP), (c) Collagen I and (d) Oesteocalcin (OCN) []. Reproduced with permission from the American Chemical Society, published by the American Chemical Society, 2015.
Как уже упоминалось, оксигенированные группы GO обеспечивают активные участки для осаждения минерала фосфата кальция на поверхности электроспана PCL/0,3 мас.% GO путем погружения в раствор 10 SBF []. Fu et al. сообщалось, что включение 2 мас.% GO в PCL приводит к осаждению кальция мышиными предостеобластами MC3T3-E1 на поверхности электрошпунного мата PCL/GO, как показано окрашиванием Alizarin red S []. Песня и др. изучали влияние различного содержания наполнителя GO (0,1, 0,3, 0,5 и 1,0 мас.%) в электроспановых каркасах PCL/GO на пролиферацию и дифференцировку мезенхимальных стволовых клеток (ММСК) костного мозга мыши []. На 7-й день уровни экспрессии генов ALP и Runx2 повышаются с увеличением содержания GO на начальной стадии дифференцировки клеток. Таким образом, PCL/1 мас.% GO mat демонстрирует самый высокий уровень экспрессии генов ALP и Runx2 (). Runx2 является специфичным для остеогенеза фактором транскрипции, который имеет решающее значение для дифференцировки и созревания остеобластов. На 14 - й день уровни этих генов снижаются по мере того, как клетки переходят к поздней стадии дифференцировки. Однако уровень гена OCN в циновках PCL/GO с содержанием GO ≥0,3 мас.% заметно возрастает на 14-й день. OCN является маркером формирования кости и секретируется остеобластами, и он участвует в поздней стадии минерализации. Из литературы следует, что остеогенная дифференцировка ММСК in vitro протекает в несколько стадий. Первая стадия состоит из усиленной клеточной адгезии и пролиферации (1-4-е сутки), за которой следует ранняя дифференцировка клеток, о чем свидетельствует повышенная активность ALP (5-14-е сутки). После этого уровень ALP начинает снижаться, и минерализация приводит к высоким уровням OCN и остеопонтина (OPN), за которыми следует осаждение Ca и фосфатов (дни с 14 по 28) []. OPN-это интегрин-связывающий гликопротеин, присутствующий в костном матриксе, который важен для ремоделирования костей и передачи сигналов иммунной системы. В целом, периоды дифференцировки клеток сильно варьируются от одного к другому, в зависимости от условий культивирования клеток. Помимо остеогенной дифференцировки МСК, сообщалось, что нановолокна с электроспаном PCL/GO направляют дифференцировку нервных стволовых клеток в зрелые олигодендроциты, т. е. миелинизирующие клетки центральной нервной системы [].
Анализ экспрессии генов ALP, Runx2, OCN и OPN для мезенхимальных стволовых клеток костного мозга мыши (ММСК), дифференцированных на нанокомпозитных каркасах PCL/GO с электрораспылением с различным содержанием GO на 7-й и 14-й день соответственно. * представляет собой значительную разницу между различными группами материалов []. Воспроизведено с разрешения Elsevier, опубликовано Elsevier, 2015.
В настоящее время рассматривается дифференцировка клеток на гибридных композитных каркасах. Fu et al. проведено всестороннее исследование структуры, поведения при растяжении и смачиваемости электроспун PLGA, PLGA/10 мас.% nHA, PLGA/2 мас.% GO и PLGA/10 мас.% nHA-2 мас.% GO строительных лесов. В целом, гибридный каркас PLGA/10 мас.% nHA-2 мас.% GO обладает самой высокой прочностью на растяжение и превосходной гидрофильностью по сравнению с чистыми ковриками PLGA, PLGA/10 мас.% nHA и PLGA/2 мас.% GO []. Окрашивание ализариновым красным S использовали для оценки отложения кальция клетками MC3T3-E1, культивированными на всех волокнистых каркасах в течение 14 и 21 дней. Они продемонстрировали, что гибридный каркас PLGA/10 мас.% nHA-2 мас.% GO значительно усиливал адгезию и пролиферацию клеток MCET3-E1 и эффективно стимулировал их активность ALP и отложение минералов (), а также повышал экспрессию остеогенных генов Runx2 и OPN (). По-видимому, каркас PLGA/10 мас.% nHA-2 мас.% GO демонстрировал самые высокие уровни экспрессии генов Runx2 и OPN, а также отложение кальция по сравнению с другими нановолокнистыми матами. Эти результаты подразумевали, что гибридизация нанонаполнителей GO и nHA полезна для усиления остеодифференцировки клеток MC3T3-E1.
А) Активность ALP клеток MC3T3-E1, культивируемых на электроспановых матах PLGA, PLGA/2 мас.% GO, PLGA/10 мас.% nHA и PLGA/10 мас.% nHA-2 мас.% GO в течение 7 и 14 дней. (B) Отложение кальция после культивирования клеток на этих нановолокнистых матах в течение 14 и 21 дней. * представляет собой значительную разницу между различными группами материалов; p < 0,05, n = 4. [], PLOS по лицензии Creative Commons Attribution.
Количественный ОТ-ПЦР анализ экспрессии остеогенных генов: (А) Runx2 и (B) OPN для клеток MC3T3-E1, культивируемых на волокнистых матах на основе PLGA в течение 7 дней; * представляет собой значительную разницу между различными группами материалов; p < 0,05, n = 3. [], PLOS по лицензии Creative Commons Attribution.
Как уже упоминалось, технология AM позволяет создавать бионанокомпозитные каркасы с точно контролируемым размером пор, пористостью и взаимосвязанной сетью пор. Благодаря включению этих факторов пор в проектные модели, построенные 3D-каркасы обеспечивают эффективное проникновение клеток, рост тканей и васкуляризацию []. Хуан и др. использовали систему AM на основе экструзии для печати 3D PCL, PCL/10 мас.% nHA, PCL/20 мас.% nHA, PCL/10 мас.% TCP и PCL/20 мас.% TCP-каркасов []. Жизнеспособность клеток стволовых клеток, полученных из жировой ткани человека (hADSC), посеянных на такие нанокомпозитные каркасы, оценивали методом анализа Alamar Blue (). На 14-й день каркасы PCL/10 мас.% nHA и PCL/20 мас.% nHA, особенно последние, демонстрировали более высокую интенсивность флуоресценции по сравнению с чистыми каркасами PCL и PCL/TCP. Это привело к увеличению клеточной пролиферации на их поверхностях, что подразумевает хорошую биосовместимость каркасов PCL/nHA. изображает морфологию клеток PCL, PCL/10 мас.% nHA, PCL/20 мас.% nHA, PCL/10 мас.% TCP и PCL/20 мас.% TCP-каркасов на 14-й день. Можно видеть, что очень немногие клетки прилипают и мигрируют на каркасе 3D PCL из-за его низкой биоактивности. Тем не менее, эти клетки, как правило, соединяют полимерные слои и нити каркаса. Для каркасов PCL/10 мас.% nHA, PCL/20 мас.% nHA, PCL/10 мас.% TCP и PCL/20 мас.% TCP жировые стволовые клетки, как правило, соединяются друг с другом, образуя плотные и непрерывные клеточные листы. Эти клеточные листы также соединяются через нити, демонстрируя, что каркасы могут поддерживать адгезию и рост стволовых клеток. Отмечается, что та же исследовательская группа также изготовила 3D-каркасы из графена PCL/LPE с рисунком укладки 0°/90° с использованием системы AM на основе экструзии []. Аналогичным образом, видно, что листы ячеек hADSC соединяют ортогональные нити каркаса, несмотря на присутствие остаточных органических растворителей в LPE-графене. Кроме того, LPE-графен полезен для повышения гидрофильности 3D-печатных каркасов PCL/графена, как упоминалось ранее. Это демонстрирует, что LPE-графен очень эффективен для стимулирования прикрепления и пролиферации жировых стволовых клеток.
Fluorescent intensity of human adipose derived stem cells (hADSCs) seeded on the PCL and its nanocomposite scaffolds; * p < 0.05 and ** p < 0.01. Reproduced from [], MDPI under the Creative Commons Attribution (CC BY) license ().
Откроется в отдельном окне
SEM-изображения, показывающие прикрепление ячеек и соединение ячеек на PCL, PCL/10 мас.% nHA, PCL/20 мас.% nHA, PCL/10 мас.% TCP и PCL/20 мас.% TCP-каркасов соответственно. [], MDPI по лицензии Creative Commons Attribution (CC BY) ().
Ся и др. исследовали биоактивность и биосовместимость изготовленных из SLS каркасов PCL/(5-15 мас.%) nHA []. Они сообщили, что наполнители nHA способствуют образованию кристаллов апатита на каркасах PCL/nHA при погружении в раствор SBF при 37 °C. Кроме того, включение nHA в PCL было полезным для усиления адгезии, пролиферации HMSC на основе анализа CCK-8. В частности, PCL/15 мас.% nHA демонстрировал самую высокую пролиферацию клеток, таким образом, он обеспечивал отличную микроокружение для роста HMSC. Кроме того, PCL/15 мас.% nHA также демонстрировал самый высокий уровень экспрессии ALP. Окрашивание ализариновым красным S показало, что отложение кальция клеток hMSCs, культивируемых на каркасах PCL/nHA, более очевидно, чем на каркасах PCL, особенно для PCL/15 мас.% nHA. Это подразумевало, что каркасы PCL/nHA способствуют большей минерализации hMSC, чем их аналог PCL.
5. Модели Животных In Vivo
По сравнению с культивированием клеток in vitro в литературе имеется меньше информации, касающейся моделей животных in vivo пористых каркасов, полученных из алифатических полиэфиров, армированных nHA и/или GO, а также их гибридных нанополнителей. Чистые полимеры PLA и PCL являются гидрофобными, поэтому им не хватает биоактивных участков для адгезии клеток. В отсутствие nHA или GO чистые алифатические полиэфирные каркасы должны быть заполнены биоактивными молекулами или факторами роста с последующей имплантацией в костные дефекты животных моделей. Например, Чжан и др. загружали симвастатин (SIM) в 3D-каркасы PLGA, изготовленные методом FDM; коллаген также был включен в каркасы для активации поверхности []. Они сообщили, что такие каркасы PLGA/Col/SIM могут индуцировать образование новой кости в дефектах, созданных в бедренных костях крыс Спрэга-Доули. Уильямс и др. проведено исследование in vivo SLS-обработанных PCL-каркасов на мышах. Каркасы были засеяны трансдуцированными BMP-7 фибробластами и имплантированы подкожно мышам для индуцирования врастания костной ткани [].
Монкаль и др. приготовил раствор микрокомпозитных чернил, состоящий из микрочастиц PLGA, PCL и HA в соотношении 4,5:4,5:1, и напечатал его в 3D в пористых конструкциях []. Затем напечатанные конструкции были имплантированы в дефекты голени крысы. Результаты показали, что 3D-печатные микрокомпозитные конструкции PLGA-PCL/HA способствуют регенерации костной ткани за счет образования минерализованной костной ткани и кровеносных сосудов. Совсем недавно Нгуен и др. имплантированный нанокомпозит PLA/30 мас.% d-nHA, отлитый из растворителя, в бедра собак []. В качестве наполнителя использовался наногидроксиапатит, легированный магнием и цинком (d-nHA). Они сообщили, что нанокомпозит не вызывал остеита, остеомиелита или структурных нарушений после имплантации в течение трех месяцев. Гистологическое и рентгеновское изображение показало, что материал имплантата эффективно способствует росту новой кости. Чжан и др. объединили инверсию фазы и выщелачивание порогена для изготовления каркаса PLGA/10 мас.% nHA. Затем этот каркас покрывали полидопамином (PDA), а затем обрабатывали либо BMP-2, либо инсулиноподобным фактором роста 1 (IGF-1) []. Как BMP-2, так и IGF-1 иммобилизованные каркасы PLGA/10 мас.% nHA были, наконец, имплантированы в дефекты лучевой кости кролика, что привело к высочайшей остеокондуктивности и отличной способности к заживлению костей.
Ся и др. сообщалось, что обработанный SLS каркас PCL/15 мас.% nHA имел самую высокую пролиферацию клеток, самую высокую активность ALP и наиболее очевидное окрашивание ализариновым красным S []. Таким образом, PCL/15 мас.% nHA и чистые 3D-каркасы PCL были имплантированы отдельно новозеландским кроликам для изучения остеогенеза in vivo. Костные дефекты были созданы в дистальном отделе бедренной кости кроликов, и затем все каркасы были имплантированы в дефекты. Затем кроликов сканировали в системе микрокомпьютерной томографии (microCT) в моменты времени 3, 6 и 9 недель (). После операции на 3-й неделе каркасы в костных дефектах оставались видимыми в контрольных, имплантированных группах кроликов PCL и PCL/15 мас.% nHA. Микротомограммы не выявили образования костей в мышцах. На 6-й неделе каркас PCL/15 мас.% nHA был почти заполнен новообразованной костной тканью. На 9-й неделе она показала почти полную деградацию и обширное врастание кости по всему дефекту. По-видимому, наполнитель nHA полезен для ускорения скорости деградации PCL в условиях in vivo и in vitro []. Кроме того, nHA также способствует росту новых костей in vivo.
Изображения микроремонтной реконструкции каркасов PCL и PCL/15 мас.% nHA, имплантированных в дистальный отдел бедренной кости кролика в течение 3, 6 и 9 недель. Кружок обозначает имплантированную область. [], Dove Medical Press под лицензией Creative Commons Attribution—Некоммерческая (несообщаемая, v3.0) лицензия.
В настоящее время нет информации, касающейся животных моделей алифатических полиэфиров, армированных GO и его производными, in vivo. Для другого биоматериала из сополиэфира Чжоу и др. проведено исследование восстановления костной ткани in vivo из электроспанового поли(3-гидроксибутират-со-4-гидроксибутират)/ГО каркаса. Каркас P3-4HB/GO был имплантирован в полнослойные дефекты голени крысы []. Они сообщили, что нанонаполнители GO способствуют образованию новой кости при дефектах костей крыс. Ли и др. изготовили гибридные трансплантаты rGO/HA, а затем имплантировали в дефекты костей голени 12-13-недельных самцов новозеландских белых кроликов []. В их исследовании у кроликов путем трепанации были обнаружены дефекты костей голени полной толщины (диаметром 6 мм и глубиной 2,5 мм). Затем гибридные трансплантаты rGO/HA были посеяны в голеностопные кости кроликов, в то время как в качестве контрольной модели использовались необработанные дефекты костей у других кроликов без трансплантатов. Для целей сравнения трансплантаты HA также были посеяны в кости голени. Они сообщили, что гибридные трансплантаты rGO/HA были очень эффективны для стимулирования образования новой кости при дефектах голени кролика по сравнению с трансплантатами HA (А). Для контрольной модели необработанные дефекты были заполнены тонкими и рыхлыми соединительными тканями с минимальным образованием новой кости после четырех недель операции (левая панель рисунка). Напротив, дефекты, обработанные трансплантатами HA, были заполнены плотной соединительной тканью (центральная панель). Кроме того, в дефектах, обработанных гибридными трансплантатами rGO/HA, наблюдалось несколько новообразованных костей, демонстрирующих ускоренный процесс ремоделирования кости (правая панель). Гистометрический анализ показал, что новая плотность костной ткани в гибридных трансплантатах rGO/HA была значительно выше, чем в других группах (Б). В этом отношении ожидается, что гибридные нанокомпозитные каркасы PLA/rGO/HA также будут способствовать образованию новых костей при имплантации в модели животных. Необходима дальнейшая работа для выяснения этого полезного эффекта в разлагаемых полимерных бионанокомпозитах. Совсем недавно Пенг и др. изготовили неразлагаемые каркасы PEEK/nHA, армированные 1 мас.%, которые проходят процесс FDM []. Отмечается, что PEEK не является полиэстером. Затем каркасы были имплантированы в дефекты лучевой кости кролика. Они сообщили, что новая кость сформировалась по всему каркасу после имплантации в течение 60 дней.
Откроется в отдельном окне
Гистологические исследования. (А) Оптические изображения при окрашивании гематоксилин-эозином (ОН). (a–c): необработанный контроль, (d–f): дефекты, обработанные трансплантатами HA, и (g–i): дефекты, обработанные трансплантатами rGO/HA. Первоначальное увеличение: ×12,5 дюйма (a,d,g) и ×50 в остальных. Символы: nb, новая кость; s, мягкие ткани; fv, фиброваскулярная ткань; *, материалы для трансплантации. (B) Образование новой кости (%).Данные выражаются в виде среднего значения ± SD (n = 4) на основе, по крайней мере, повторяющихся наблюдений. Маленькие буквы обозначают значительную разницу между необработанным контролем и дефектами, имплантированными трансплантатами HA и rGO/HA, p [], Nature Research по лицензии Creative Commons Attribution ().
Несмотря на остеогенез, индуцированный наполнителями GO каркаса P3-4HB/GO in vivo [], биобезопасность GO является важной проблемой для его применения в инженерии костной ткани. После регенерации кости биоразлагаемые алифатические полиэфиры со временем разлагаются, поэтому нанонаполнители GO остаются в ткани хозяина. Нанонаполнители GO трудно удалить из ткани хозяина из-за их наноразмерных размеров. В связи с этим цитотоксичность ГО становится серьезной проблемой для его клинического применения. Биосовместимость и цитотоксичность автономных GO in vivo широко изучены [,]. Сообщалось о противоречивых результатах, касающихся клеточных реакций на автономный GO и его производные in vivo. Например, Али-Бусетта и др. установлено, что GO не вызывал воспаления и образования гранулем у мышей после внутрибрюшинной инъекции []. Ян и др. показано, что GO сохранялся в тканях мышей в течение длительного периода времени после внутрибрюшинной инъекции, его токсичность для мышей была незначительной []. Однако другие работники сообщили, что GOs может индуцировать цитотоксичность на животных моделях, и цитотоксический эффект зависел от дозы и размера GOs []. До настоящего времени в литературе не существует сообщений о биологических эффектах и цитотоксичности, индуцируемых нанонаполнителями GO алифатических полиэфирных каркасов. Недавно Канаяма и др. покрытые коллагеновые каркасы с GO и rGO, а затем подкожно имплантированные самцам крыс линии Вистар []. При гистологическом исследовании тканей крыс они сообщили, что воспалительные клетки, такие как нейтрофилы и лимфоциты, наблюдались редко. Вместо этого появились многочисленные макрофаги, которые поглощали GO и rGO, образуя гигантские клетки. Поэтому необходима тщательная оценка биосовместимости и цитотоксичности алифатических полиэфирных/ГО-каркасов in vivo для применения в инженерии костной ткани.
6. Выводы
Мы представили текущие тенденции в разработке алифатических полиэфирных каркасов, армированных nHA и/или GO и их производными, особенно за последние четыре года. Систематически рассматриваются изготовление, структура, механическое поведение, гидролитическая деградация, биоминерализация, культивирование клеток in vitro и исследования моделей животных in vivo таких каркасов. Наногидроксиаптит и ГО являются отличным подкреплением для алифатических полиэфирных каркасов, которые обеспечивают механическую поддержку пролиферации и роста клеток во время регенерации тканей. Кроме того, нанонаполнители nHA и GO могут повышать биоактивность, адгезию и пролиферацию остеобластных клеток, а также остеогенную дифференцировку МСК. Значительные улучшения механических свойств, биоактивности и биосовместимости алифатических полиэфирных композитных каркасов могут быть достигнуты путем гибридизации нанонаполнителей nHA и GO.
Алифатические полиэфирные нанокомпозитные каркасы могут быть изготовлены с использованием традиционных методов обработки, таких как литье в растворителе/выщелачивание частиц, НАКОНЕЧНИКИ и электроспиннинг. Эти методы требуют использования органических растворителей, которые представляют серьезную опасность для окружающей среды и здоровья человека. Основными недостатками выщелачивания порогена являются плохой контроль геометрии пор и взаимосвязанности пор, а также сложность удаления порогенов глубоко внутри полимерной матрицы толстых каркасов. Метод НАКОНЕЧНИКОВ может привести к низкой связности и трудностям в контроле размера пор.
Было показано, что электроспановые алифатические полиэфирные нанокомпозитные каркасы, армированные нанонаполнителями nHA и GO, а также нанонаполнителями nHA/GO, обладают превосходной биоактивностью и биосовместимостью. Однако их мелкие поры препятствуют проникновению клеток in vitro, врастанию тканей in vivo и васкуляризации. В некоторых случаях средний размер пор матов PCL/nHA составляет около 2 мкм []. Остеобластическое и тканевое врастание, а также связанные с ними процессы минерализации требуют костных каркасов с крупными макропорами (200-400 мкм). В результате остеобласты могут прикрепляться только на поверхности электрошпунного мата, поэтому рост ткани ограничен периферией каркаса. В этом отношении методы 3D AM, по-видимому, очень эффективны для изготовления костных каркасов с большими макропорами. В частности, процесс FDM стал эффективным инструментом для изготовления 3D-костных каркасов с точно контролируемым размером пор, формой пор и пористостью. Помимо макропор, микропоры в нитях алифатических полиэфирных каркасов, обработанных FDM, обеспечивают лучшую среду для прикрепления, пролиферации и функционирования клеток. Кроме того, передовые технологии AM позволяют разрабатывать и изготавливать биомиметические тканевые каркасы с гораздо более высокой механической прочностью и жесткостью, чем обычные процессы изготовления.
В контексте тканевой инженерии биоинки, состоящие из нанокомпозитных компонентов и биологических клеток, представляются привлекательными для печати васкуляризованных конструкций для применения в инженерии костной ткани. Исследования новых совместимых биоматериалов для биопечати васкуляризованных конструкций находятся на эмбриональной стадии []. Ожидается, что развитие васкуляризованных сетей может способствовать образованию и ремоделированию новых тканей, что приведет к интеграции тканей хозяина при имплантации.
аконец, мы должны рассмотреть вопрос о том, вызвали ли GO и его производные токсичность для тканей человека. Противоречивые сообщения в литературе свидетельствуют о том, что GO и его производные могут быть либо биосовместимыми, либо токсичными для клеток млекопитающих []. Оксид графена, как правило, синтезируется из модифицированного процесса Хаммера путем погружения чешуек графита в сильные окислители под воздействием ультразвука. Однако для синтеза GO исследователи используют различные типы и концентрации окислителей, а также различное время окисления. Это приводит к тому, что синтезированный ГО обладает различными физико-химическими свойствами с точки зрения количества слоев, поперечных размеров, уровней примесей и соотношений C/O []. Физико-химические свойства ГО существенно влияют на его биосовместимость, цитотоксичность и биораспределение in vivo. Таким образом, чтобы избежать этих проблем, необходим стандартный протокол для синтеза GO. Мы предполагаем, что отдельные вещества, диспергированные в суспензии раствора или среде для культивирования клеток, могут вызывать цитотоксичность, проникая в цитоплазму. Однако наполнители GO из полимерных нанокомпозитных каркасов прочно связаны с полимерными матричными материалами. Таким образом, нанонаполнители GO не могут отделяться от полимерной матрицы и проникать в цитоплазму, и их цитотоксические эффекты соответственно минимизируются или устраняются. Ограниченное исследование in vivo показало, что нанонаполнители GO из неразлагаемого каркаса PEEK-nHA/1 мас.% GO нетоксичны для костной ткани кролика []. Для пористых каркасов с алифатическими полиэфирными нанокомпозитами полимерная матрица должна разрушаться, чтобы быть окончательно заменена костной тканью. Таким образом, GOs может высвободиться из каркасов и проникнуть в ткань хозяина. До настоящего времени в литературе отсутствует информация о цитотоксичности in vivo пористых каркасов, полученных из алифатических полиэфиров с нанонаполнителями GO и их производными. Таким образом, исследователи должны создавать модели животных in vivo, чтобы обеспечить безопасное использование таких новых бионанокомпозитных каркасов для применения в инженерии костной ткани.